Un système à quatre chambres, connecté à deux circulations en série de même débit mais de pressions différentes, est-il le plus adéquat ? Pour répondre à cette question, l’évolution qu’ont parcourue les différentes espèces animales nous offre 800 millions d’années d’expérimentation sur les divers systèmes circulatoires possibles [5]. Il est donc intéressant de se pencher un instant sur la paléontologie du cœur et sur les modifications de l’hémodynamique au cours de l’évolution animale. Pour davantage d’information, on se référera à l’Annexe C, où le sujet est traité de manière extensive [2].
A partir des cellules eukaryotes et des bactéries apparues il y a 1.5 milliard d’années, se sont développés des organismes pluricellulaires et organisés de symétrie radiaire comme les cnidaires (corail, méduses), puis de symétrie bilatérale avec un axe antéro-postérieur (Bilateria). De là, l’évolution a bifurqué dans deux directions : les invertébrés et les vertébrés (Figure 5.36). Le premier cœur tubulaire est apparu probablement il y a 600-800 millions d’années chez les Bilateria ; il devait être animé de mouvements péristaltiques et propulsait un liquide dans un espace péricellulaire sans vaisseaux [3].

Figure 5.36 : Schéma simplifié de l’évolution animale. Les flèches bleues représentent les invertébrés et les flèches rouges les vertébrés. Protostomes et deutérostomes, respectivement ancêtres des invertébrés et des vertébrés, sont issus d’animaux ayant acquis une symétrie bilatérale, alors que les protozoaires et les cnidaires ont une symétrie radiaire. Les amniotes se caractérisent par la présence d’une poche liquidienne (amnios) assurant la protection de l’embryon et permettant de pondre des œufs hors de l’eau.
Tant que les êtres vivants étaient des amas de cellules comme les métazoaires, la simple diffusion de l’oxygène et des nutriments suffisait à leurs besoins. Augmentant de taille et multipliant les organes, les animaux ont dû organiser un système de transport pour apporter les éléments nutritifs et l’O2, et évacuer les déchets et le CO2. Le système circulatoire peut être conçu sur deux modes.
- Un système ouvert à basse pression donnant la priorité au flux, analogue à un ventilateur dans une chambre. Ce système est fonctionnel sur de courtes distances ; il constitue la circulation périphérique chez les annélidés (vers), les arthropodes (insectes), les mollusques non-céphalopodes et les tuniqués. Le volume circulant est considérable (jusqu’à 50% du poids corporel) et consiste en un mélange de sang et de lymphe appelé hémolymphe.
- Un système fermé sous haute pression (analogue à la pompe-à-vélo), permettant de propulser le flux sur de longs trajets et de suivre les variations de la demande. On le rencontre chez tous les vertébrés, mais aussi chez les céphalopodes (poulpes) et les échinodermes (oursins). Le volume circulant est faible (6-8% du poids corporel) et ne contient que du sang.
Il existe essentiellement trois types de pompes utilisées dans la nature.
- Propulsion péristaltique, analogue à celle du tube digestif ; le flux est continu, lent et de basse pression (< 15 mmHg) ; on trouve cette circulation chez les annélidés (vers).
- Compression par une musculature extrinsèque (cœur caudal de lamproie) ; la pression générée est faible ; chez l’homme, c’est la manière dont est assurée la circulation veineuse dans les membres inférieurs. Des valves sont nécessaires pour assurer la direction du flux.
- Chambre contractile, unique (ventricule) ou multiple (renflements aortiques en série des arthropodes) ; ce système permet de hautes pressions mais implique une circulation pulsatile ; c’est le système le plus fréquemment utilisé dans le monde animal. Des valves sont requises pour empêcher le reflux.
Le cœur fait circuler le sang toujours dans la même direction, sauf chez les tuniqués, ou urochordés, qui sont un groupe d'animaux ressemblant à des sacs fixés sur le fond marin. Ils ont un cœur en forme de tube péristaltique sans valve et une circulation ouverte. Après quelques dizaines de contractions péristaltiques propulsant le liquide dans un sens, le cœur fait une pause, puis se contracte dans l'autre sens, et fait circuler le liquide en direction opposée. Ce cas de circulation bidirectionnelle est la seule exception connue à la règle du flux dirigé vers les tissus et revenant à la pompe par un circuit veineux.
Plusieurs montages circulatoires sont possibles pour assurer les échanges métaboliques et les échanges gazeux (Figure 5.37).
- Les échanges gazeux peuvent avoir lieu à travers la peau (annélidés), par des pores abdominaux (insectes), par des branchies (mollusques, poissons) ou par des poumons (reptiles, mammifères, oiseaux) par ordre croissant d’efficacité.
- Les branchies peuvent être montées sur le retour veineux (mollusques) ; le cœur reçoit du sang oxygéné qu’il propulse vers les tissus.
- Les branchies peuvent être placées entre le cœur et les tissus (poissons) ; le cœur reçoit alors du sang veineux ; cependant, il est lui-même perfusé par du sang oxygéné en provenance directe des branchies.
- Les animaux plus évolués ont deux circulations séparées (systémique et pulmonaire) ; elles peuvent avoir la même pression (amphibiens, tortues) ou des pressions différentes (oiseaux, mammifères). Dans le premier cas, le cœur ne possède qu’un seul ventricule, dans le deuxième il en possède deux.

Figure 5.37 : Différents montages circulatoires utilisés dans la nature. A : circulation simple ; les branchies sont montées sur le retour veineux (mollusques) ; le cœur reçoit du sang oxygéné qu’il propulse vers les tissus. B : les branchies sont placées entre le cœur et les tissus (poissons) ; le cœur reçoit alors du sang veineux ; il est lui-même perfusé par du sang artérialisé venant directement des branchies. C : deux circulations séparées (systémique et pulmonaire) ; elles peuvent avoir la même pression (reptiles, sauriens) ou des pressions différentes (oiseaux, mammifères). Dans le premier cas, le cœur ne possède qu’un seul ventricule, dans le deuxième il en possède deux.
La présence d’un transporteur d’O2 augmente 20-40 fois la capacité du sang à acheminer l’O2 aux cellules. Deux pigments hèmes différents sont utilisés dans la nature.
- L’hémocyanine à base de cuivre (Cu2+), d’où la couleur verdâtre du sang de la plupart des invertébrés ; elle n’existe que sous forme dissoute et transporte 4-5 vol% d’O2.
- L’hémoglobine à base de fer (Fe2+), dont il existe plusieurs variétés et qui est commune à tous les vertébrés ; elle est enfermée à haute concentration dans les globules rouges et transporte environ 20 vol% d’O2.
Il est intéressant d’examiner quelques exemples de différents types de circulation sélectionnés en remontant la chaîne de l’évolution [13].
Invertébrés
Les annélidés (vers) possèdent une seule circulation faite de deux tubes péristaltiques (ventral et dorsal) et de connexions latérales (Figure 5.38A) ; c’est un système de perfusion lent (6-8 ondes péristaltiques par minute), continu, à basse pression (≤ 12 mmHg), ne permettant guère de variations de débit, et ne s’accommodant que d’un métabolisme très bas. Les annélidés respirent par la peau.
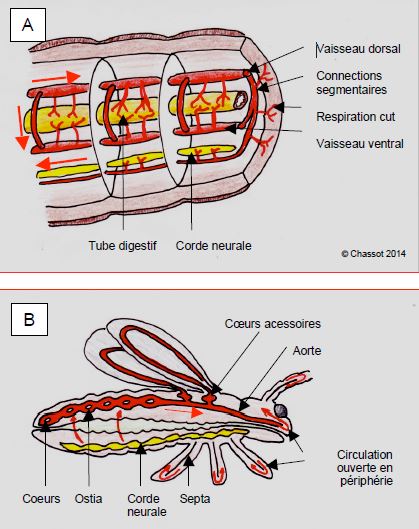
Figure 5.38 : Systèmes circulatoires des annélidés et des insectes. A : chez les vers (annélidés), la circulation suit un mode péristaltique de long de deux tubes (dorsal et ventral) reliés par des circuits collatéraux au niveau de chaque anneau. La respiration est cutanée. B : chez les arthropodes (insectes, araignées), des cœurs abdominaux propulsent le sang dans l’aorte, la circulation périphérique est ouverte (absence de capillaires) ; certains ont des cœurs accessoires au niveau des ailes, des pattes ou des antennes. La contraction-relaxation abdominale apporte une aide considérable au flux sanguin.
Les arthropodes (insectes, arachnidés) ont une série de renflements pulsatiles abdominaux (cœurs en série) le long d’un vaisseau dorsal (aorte) et respirent par des opercules situés latéralement sur l’abdomen (Figure 5.38B) [10]. Les cœurs synchronisés propulsent le sang dans l’aorte en se contractant ; leur remplissage est assuré par des muscles suspenseurs fixés aux parois de l’abdomen. En périphérie, la circulation est ouverte, le liquide circulant librement dans l’espace interstitiel à l’intérieur de la carapace et des organes, où il est dirigé par un réseau de membranes. C’est un système à basse pression (20/10 mmHg), qui ne permet pas de dépasser une taille de 15 cm parce que la diffusion interstitielle ne peut se faire que sur de courtes distances. A la base des ailes, certains insectes comme les mouches et les abeilles, présentent des renflements circulatoires particulièrement développés, appelés cœurs accessoires, assurant un débit plus élevé dans les ailes, dont le métabolisme est très élevés pendant le vol. Les insectes sauteurs ont le même arrangement au niveau des pattes. Chez les insectes, le sang ne joue pas de rôle particulier dans la respiration; le transport des gaz est fourni jusqu'en périphérie par un réseau de tubes très fins où le déplacement de l'air est assuré par la contraction et la relaxation de l'abdomen. Ces mouvements de l’abdomen apportent une aide considérable au flux sanguin et sont essentiels au brassage de l’hémolymphe pendant les efforts. Chez les arachnidés (araignées, scorpions), le système circulatoire est identique mais le sang participe au transport d'O2 par un pigment d'hémocyanine, et on trouve le premier développement d'organes respiratoires où le sang entre en contact avec l'air [14].
Les crustacés (crabes, homards) présentent un cœur unique constitué d’une seule cavité contractile suspendue au péricarde par des ligaments élastiques qui assurent l’expansion diastolique (Figure 5.39). Le sang revient dans le péricarde et baigne la masse contractile ; en diastole, il pénètre dans la cavité ventriculaire par des canaux traversant la paroi myocardique ; en systole, la contraction obture ces orifices et le sang est éjecté dans l’aorte. Des branchies pour les échanges gazeux sont placées sur le circuit de retour veineux au cœur, qui est lui-même vascularisé par du sang artériel. Le pigment transporteur d’O2 est de l’hémocyanine.

Figure 5.39 : Système circulatoire des crustacés. Ils présentent un cœur unique constitué d’une seule cavité contractile suspendue au péricarde par des ligaments élastiques (en vert) qui assurent l’expansion diastolique [Extrait de: Schmidt-Nielsen K. Réf 13]. Le sang revient dans le péricarde (pointillé rouge CP) et baigne la masse contractile ; en diastole, il pénètre dans la cavité ventriculaire par des ostia traversant la paroi myocardique (flèche rouge) ; en systole, la contraction obture ces orifices et le sang est éjecté dans l’aorte. Des branchies pour les échanges gazeux sont placées sur le circuit de retour veineux au cœur [98]. VB : vaisseaux branchiaux. C : cœur. CP : cavité péricardique.
Les mollusques (escargots, moules) ont subi une très longue évolution (500 millions d’années), et présentent différents systèmes circulatoires (Figure 5.40). Ils sont les premiers à posséder un cœur à deux chambres constitué d’un ventricule et d’une oreillette. Celle-ci constitue un double avantage hémodynamique: 1) elle fonctionne comme un réservoir-tampon entre le retour veineux continu et l’éjection pulsatile, et 2) sa contraction permet d'élever la pression télédiastolique ventriculaire sans augmenter la pression veineuse moyenne. Le pigment transporteur d’O2 est également de l’hémocyanine. A l'exception des céphalopodes, les mollusques ont un système circulatoire ouvert en périphérie.

Figure 5.40 : Système circulatoire des mollusques. A : cœur d’escargot à deux chambres, un ventricule et une oreillette séparés par une valve direc-tionnelle. B : circulation des céphalopodes, avec deux cœurs accessoires à basse pression (BP) sur le retour veineux vers les branchies, et un cœur systémique perfusant les organes à haute pression (HP).
Les céphalopodes (poulpes, calmars), les plus évolués d’entre les mollusques, possèdent une circulation fermée avec un réseau de capillaires, et une double hémodynamique. Premièrement, un cœur bicavitaire recueillant le sang des branchies le propulse dans la circulation systémique à haute pression (50-75 mmHg), et, deuxièmement, deux cavités pulsatiles accessoires (droite et gauche) poussent le sang dans les branchies latérales sous un régime à plus basse pression (20 mmHg). Il y a donc un seul circuit en série, mais deux régimes de pression différents. C’est la première apparition d’une circulation respiratoire à basse pression pour faciliter les échanges gazeux et d’une circulation systémique à plus haute pression pour assurer plus efficacement les besoins métaboliques. Le pigment est aussi de l’hémocyanine.
Vertébrés
Les ancêtres des vertébrés sont les chordés, qui ressemblent à des petits poissons ou à des vers marins, mais qui présentent un système nerveux dorsal protégé par une enveloppe fibreuse ancêtre de la colonne vertébrale, et un cœur fait de plusieurs chambres pulsatiles se succédant le long d’un tube circulatoire. Ces chambres vont donner successivement le sinus venosus et l’oreillette pour le flux d’admission, le canal auriculo-ventriculaire valvé, le ventricule et le conus arteriosus pour le flux d’éjection. On retrouvera les mêmes formations au cours de l’embryogenèse de tous les vertébrés. Au cours de l’évolution, le tube cardiaque va se plier sur lui-même de manière à amener l’oreillette d’abord en arrière du ventricule, puis à côté de la chambre d’éjection (Figure 5.41) [10,12]. L’avantage de cette configuration est d’éviter que le sang s’arrête et redémarre entre la diastole et la systole, mais au contraire qu’il soit animé en permanence d’un mouvement tournoyant évitant la perte d’énergie cinétique et plaçant le volume sanguin toujours en ligne avec la chambre suivante [8].

Figure 5.41 : Evolution anatomique du cœur chez les vertébrés. A : poissons primitifs (cyclostomes) et actuels. B : amphibiens (grenouilles) et amniotes (reptiles, oiseaux et mammifères). Par rapport au tube primitif, le cœur se plie progressivement sur lui-même pour amener la chambre d’admission et la chambre de chasse côte-à-côte en position céphalique [10,12]. C et D : représentation schématique des flux à l’intérieur du cœur de mammifère ; le tournoiement continu est de plus en plus efficace pour limiter la perte d’énergie cinétique et pour placer le volume sanguin en face de la chambre suivante [8]. SV : sinus venosus. O : oreillette. V : ventricule. CA : conus arteriosus. Ao : aorte.
Les cyclostomes (lamproie), qui sont des poissons primitifs ressemblant aux anguilles, possèdent plusieurs cœurs dont un cœur caudal longiligne constitué de deux chambres parallèles entourant un cartilage central ; la contraction alternée de deux muscles externes longitudinaux fait basculer le cartilage d’un côté et de l’autre, ce qui vide une chambre et remplit simultanément l’autre. Ce système ne doit pas être très performant, car il n’a pas été retenu dans l’évolution et n’est présent que chez ces animaux hors d’âge.
Les poissons (téléostes) présentent un cœur à deux chambres et une circulation unique cœur → branchies → tissus (Figure 5.42). Un sinus veineux précédant l'oreillette fait office de réservoir-tampon sur le retour veineux et un cône artériel très élastique amortit la pulsatilité du sang artériel à la sortie du ventricule (pression artérielle: 30/15 mmHg). Parmi les poissons, les élasmobranches (requins) ont un péricarde cartilagineux rigide. De ce fait, la pression intrapéricardique devient négative (- 4 mmHg) lorsque le ventricule diminue de taille en systole; ce mécanisme facilite l'aspiration du sang dans l'oreillette en déplaçant le liquide péricardique autour du ventricule et en dégageant l'oreillette. En diastole, le liquide est refoulé par la dilatation ventriculaire autour de l'oreillette, ce qui facilite la vidange de celle-ci dans le ventricule. Les squales disposent en plus d’un système original : la persistance du canal péricardo-péritonéal permet d’évacuer momentanément le liquide péricardique dans l’abdomen pour augmenter le volume des cavités cardiaque comme on draine une tamponnade [6].

Figure 5.42 : Cœur de poisson comprenant deux chambres (oreillette O et ventricule V) et une valve directionnelle. Chez les requins, il baigne dans un liquide péricardique (LP) qui se déplace selon le rythme cardiaque. A : en systole, la contraction de ce dernier fait de la place dans le péricarde et le liquide décomprime l’oreillette, dont le remplissage est facilité. B : en diastole, le ventricule occupe davantage de volume, le liquide est refoulé autour de l’oreillette, dont la compression accélère la vidange dans le ventricule. CPP : canal péricardo-péritonéal permettant le drainage du liquide péricardique dans l’abdomen [6]. SV : sinus venosus.
Les amphibiens (grenouilles, salamandres) ont un cœur à trois chambres (2 oreillettes et 1 ventricule) ; une oreillette reçoit du sang veineux des tissus et l’autre du sang oxygéné des poumons (Figure 5.43). Dans le ventricule, ces sangs circulent en parallèle et ne se mélangent pratiquement pas : le sang veineux est expulsé dans une artère pulmonaire, et le sang artérialisé dans une aorte. Comme il n’existe qu’un seul ventricule, la pression est identique dans le circuit pulmonaire et dans le circuit systémique. Chez les amphibiens, cela n’est pas un inconvénient pour deux raisons :
- La pression du système circulatoire est basse (pression systolique : ≤ 40 mmHg, diastolique : ≤ 30 mmHg) ;
- Un circuit cutané est monté en dérivation du circuit pulmonaire, car les batraciens assurent leurs échanges gazeux par la peau lorsqu'ils sont sous l'eau ; ce circuit présente des résistances vasculaires identiques aux résistances systémiques, donc plus élevées que celles du circuit pulmonaire.


Figure 5.43 : Cœur d’amphibien. A : cœur à 3 chambres (1 ventricule et 2 oreillettes) ; une oreillette reçoit du sang veineux et l’autre du sang oxygéné [Extrait de Réf 13]. B : Dans le ventricule, ces sangs circulent en parallèle et ne se mélangent pratiquement pas : le sang veineux est expulsé dans une AP, et le sang artérialisé dans une aorte. Comme il n’existe qu’un seul ventricule, la pression est identique dans le circuit pulmonaire et dans le circuit systémique. La circulation pulmonaire comprend un circuit cutané (25% des échanges gazeux). Il existe un sphincter (C) à l’origine de l’AP qui abaisse le flux pulmonaire et le dévie vers la peau en plongée.
L’artère pulmonaire des batraciens est dotée d’une puissante musculature circulaire (représentée en C dans la Figure 5.43). En plongée, sa vasoconstriction diminue le flux pulmonaire, et le sang est dirigé préférentiellement vers la circulation cutanée.
Les reptiles présentent une transition entre le cœur à trois chambres des amphibiens et la circulation double avec un cœur à quatre chambres des oiseaux et des mammifères. Ils varient d’un ventricule unique partiellement divisé par un septum interventriculaire (tortues), à deux ventricules différents reliés par une communication interventriculaire (pythons, varans) ou à deux ventricules complètement séparés (crocodiles) (Figure 5.44A). Pour éviter que la pression pulmonaire soit identique à la pression systémique, une crête musculaire surmontant le septum interventriculaire se contracte en systole et obstrue plus ou moins complètement cette CIV. Celle-ci maintient un shunt, qui peut être droit-gauche ou gauche-droit selon le jeu des pressions. Le shunt est important chez les tortues, mais minime chez les pythons et les varans [7]. Les reptiles possèdent une seule artère pulmonaire mais deux aortes (droite et gauche). Les crocodiliens ont un cœur à quatre chambres complètement séparées ; toutefois, leur aorte gauche est issue du ventricule droit et communique avec l’aorte droite (issue du VG) par un orifice appelé foramen de Panizza (Figure 5.44B). La présence d’un shunt variable chez les reptiles est peut-être un reliquat évolutif, mais il a l’avantage de maintenir une certaine indépendance entre les débits du cœur droit et du cœur gauche, qui peuvent varier selon les modifications des résistances artérielles pulmonaires et systémiques lorsque l’animal passe de la respiration en surface à la plongée. Lorsque les deux circulations sont totalement séparées comme chez les oiseaux et les mammifères, le débit droit et le débit gauche doivent être rigoureusement identiques.
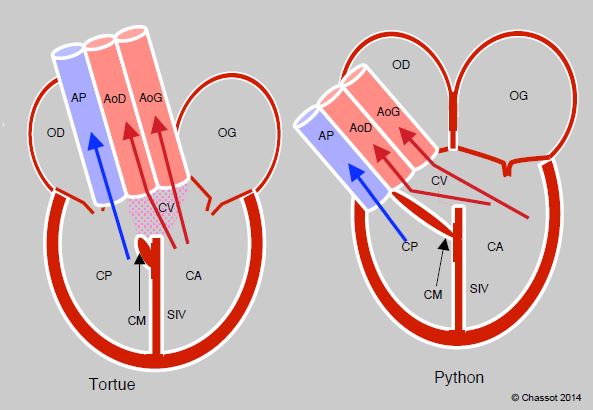
Figure 5.44 A : Cœurs de reptiles. Chez la tortue, le ventricule est partiellement divisé en cavum pulmonaire (CP) et cavum arteriosum (CA) par un septum interventriculaire (SIV) laissant une large communication interventriculaire (CIV) sous les deux aortes, appelée cavum venosum (CV). L’alignemnt des flux fait que le sang veineux désaturé va principalement dans l’AP et le sang oxygéné principalement dans les aortes. Le shunt D – G apparaît dès que la pression augmente dans l’AP, comme en plongée. L’anatomie est plus perfectionnée chez les pythons et les varans : en systole, la contraction de la crête musculaire (CM) sitée à l’extrémité du septum obstrue complètement la CIV et sépare le sang veineux du sang artérialisé. Le shunt est quasi-inexistant. De plus, la pression est 2-3 fois plus élevée dans le cavum arteriosum, équivalent au VG, que dans le cavum pulmonale, équivalent au VD.
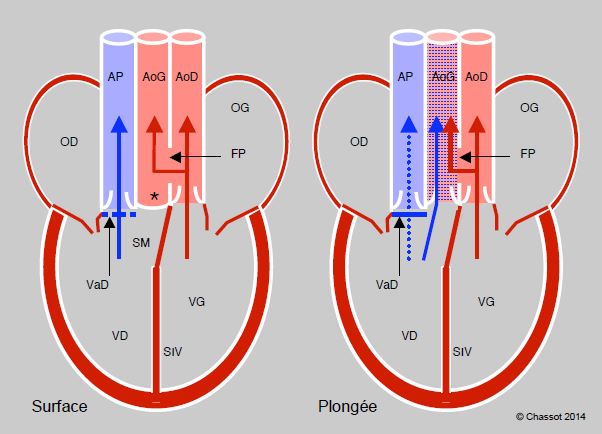
Figure 5.44 B : Cœur de reptiles : crocodiles. Les ventricules sont complètement séparés, mais l’aorte gauche provient du VD, alors que l’aorte droite provient du VG. A leur racine, le foramen de Panizza (FP) les fait communiquer entre elles. La valve dentée (VaD) est un ensemble de nodules fibreux situés dans la chambre de chasse droite. Lorsque le crocodile respire à l’air (Surface), la VaD est ouverte et le flux est libre dans l’artère pulmonaire (AP), qui reçoit tout le sang veineux désaturé. Comme la pression du VG est plus élevée que celle du VD, la pression dans l’AoG est plus élevée que celle du VD et sa valve est fermée (*) ; le flux de l’AoG provient de l’AoD par le foramen de Panizza. En plongée (Plongée), la contraction de la VaD obstrue complètement le flux vers l’AP ; de ce fait, la pression monte dans le VD et l’éjection est possible du VD vers l’AoG, qui reçoit alors du sang désaturé. Il se crée un shunt droite - gauche. AoG : aorte gauche. AoD : aorte droite. SM : septum membraneux. SIV : septum interventriculaire.
Les oiseaux et les mammifères sont les seuls homéothermes : au prix d’une très forte demande métabolique, ils maintiennent leur température corporelle aux environs de 37°C, ce qui rend leur activité indépendante de la température du milieu ambiant. Il sont aussi les seuls à posséder un cœur à quatre cavités et deux circulations complètement séparées (voir ci-dessus Figure 5.37C).
- Un circuit systémique à haute pression pour répondre aux besoins métaboliques élevés : 120/60 mmHg chez les mammifères, 160/40 mmHg chez les oiseaux ; certaines espèces d’oiseaux ont une pression systolique jusqu’à 250 mmHg ;
- Un circuit pulmonaire à basse pression pour faciliter les échanges gazeux : 25/15 mmHg chez les mammifères, 20/10 mmHg chez les oiseaux ; les poumons de ces derniers assurent des échanges gazeux 50% plus efficaces que ceux des mammifères.
Le point crucial de ce système est l’interdépendance des deux circulations : les deux ventricules doivent battre de manière synchrone et avoir rigoureusement le même volume systolique, contrairement aux reptiles dont la CIV permet une ré-équilibration des volumes éjectés en cas de variations. Le phylum des mammifères s’est détaché des premiers vertébrés terrestres il y a 300 millions d’années, alors que les oiseaux sont les descendants des reptiles. On voit ainsi que l’évolution suit des voies parallèles dans des branches différentes, et répond aux mêmes contraintes (haut débit systémique et basse pression pulmonaire) avec des solutions identiques (cœur à 4 chambres séparées).
La masse du cœur représente le 0.6% du poids du corps chez tous les mammifères, y compris l’homme; dans l'échelle animale, elle varie de 0.8% chez les oiseaux à 0.2% chez les poissons. Le volume systolique est de 12 mcL chez la musaraigne et de 350 L chez la baleine, mais son rapport à la masse corporelle est pratiquement identique. La fréquence cardiaque est fonction inverse de la taille : 600 battements par minute au repos chez la musaraigne, 25 chez l’éléphant et 6-12 chez la baleine bleue. Ceci est lié au fait que la surface corporelle augmente par rapport à la masse du corps lorsque la taille diminue ; par rapport à la taille, la surface varie au carré mais le volume au cube. Chez les animaux de petite taille, le maintien de l’homéothermie devient plus dispendieux en énergie à cause de la déperdition calorique due à une relativement grande surface corporelle par rapport à la taille, comme c’est le cas chez les nouveau-nés humains. La fréquence est donc réglée sur la consommation d'O2. L’espérance de vie des mammifères est inversément proportionnelle à leur fréquence cardiaque au repos (Figure 5.45A). Les gros animaux ont une fréquence basse et vivent plus longtemps, mais le nombre total de battements au cours de l’existence est étonnament semblable entre les espèces ; il est de 6-12 • 108, malgré de larges variations de fréquence et de durée de vie (Figure 5.45B) [4]. Chez l’homme actuel, le nombre de battement au cours d’une vie est de l’ordre de 2 • 109, parce que l’hygiène et les soins allongent artificiellement la durée de l’existence.

Figure 5.45 : A. Relation entre la fréquence cardiaque et la durée de vie chez les mammifères. Sur une échelle semilogarithmique pour la fréquence, la relation est inversement proportionnelle et presque linéaire. Les hommes en divergent parce qu’ils utilisent des moyens artificiels pour prolonger l’existence. B. Relation entre la durée de vie et le nombre de battements cardiaques au cours de leur existence individuelle chez les mammifères. Cette valeur est pratiquement constante ; elle voisine un milliard (10 • 108) [4].
L’évolution de l’hémodynamique
De nombreux systèmes circulatoires ont été adoptés dans le règne animal, mais on voit que l’évolution présente toujours des tendances identiques, même au sein d’ordres animaux aussi différents que ceux des arthropodes, des céphalopodes, des oiseaux ou des mammifères. Le débit cardiaque passe de 25 ml/min/kg chez les poissons (poïkilothermes) à 75-100 ml/min/kg chez les mammifères et 100-150 ml/min/kg chez les oiseaux (homéothermes). L’augmentation progressive des besoins métaboliques pousse à accroître constamment la pression systémique, seule solution capable de répondre à une demande de plus en plus élevée et à une activité physique de plus en plus variable. Parallèlement, on voit se différencier un système à basse pression dévolu aux échanges gazeux ; en effet, ces derniers sont d’autant plus performants que les gradients de pression alvéolo-capillaires sont bas (facilitation des échanges, membranes alvéolaires/branchiales fines). Cette différenciation existe déjà chez les poulpes et les calmars, mais est la plus marquée chez les oiseaux : leur pression systémique est en moyenne 160/40 mmHg, alors que leur pression pulmonaire n’est que 20/10 mmHg. De ce point de vue, les oiseaux sont les animaux les plus accomplis (Figure 5.46) [5]. La pression critique pour la circulation pulmonaire semble se situer entre 40 et 50 mmHg. En effet, les animaux dont la pression systémique est inférieure à 40 mmHg (arthropodes, amphibiens, reptiles) n’ont pas de circuit pulmonaire différencié. Mais dès que la pression systémique dépasse 50 mmHg, comme chez les céphalopodes, les mammifères et les oiseaux, on voit apparaître une circulation séparée à basse pression pour les échanges gazeux. Il est intéressant de noter que, chez l’homme, 50 mmHg est également la limite de pression artérielle pulmonaire au-delà de laquelle apparaissent les problèmes cliniques sérieux liés à l’hypertension pulmonaire. Il s’agit probablement d’une limite physiologique commune à tous les animaux.

Figure 5.46 : L’augmentation progressive des besoins métaboliques pousse à accroître constamment la pression systémique (traits rouges). Parallèlement, on voit se différencier un système à basse pression dévolu aux échanges gazeux (traits bleus). Cette différenciation existe déjà chez les poulpes, mais est la plus marquée chez les oiseaux. La pression critique pour la circulation pulmonaire semble se situer entre 40 et 50 mmHg : les animaux dont la pression systémique est < 40 mmHg n’ont pas de circuit pulmonaire différencié, mais ceux dont la pression systémique dépasse 50 mmHg, comme chez les céphalopodes, les mammifères et les oiseaux, bénéficient d’une circulation séparée à basse pression pour la respiration [5].
Le ventricule pulsatile est la pompe la plus couramment utilisée dans l’échelle animale, car elle offre la possibilité de hauts débits sous haute pression. Toutefois, la pulsatilité n’est pas une nécessité pour les organes périphériques, comme le prouve l’excellente survie à long terme des patients porteurs d’assistances circulatoires de type turbine à flux continu [15]. La pulsatilité diminue certes le risque de thrombose périphérique et améliore le flux lymphatique, mais elle est surtout une nécessité absolue au niveau du cœur pour deux raisons [1,15] :
- Un temps diastolique est obligatoire pour assurer le remplissage de la cavité contractile ;
- La pompe doit se perfuser elle-même ; la diastole est capitale pour permettre la perfusion myocardique. En effet, il faut un temps pendant lequel il existe un gradient de pression suffisant entre l’aorte et la pression sous-endocardique pour garantir l’apport de sang au ventricule systémique. Une pompe continue ne pourrait pas s’autoperfuser puisqu’il n’y aurait aucun ΔP entre sa pression d’éjection et celle de sa paroi.
D’ailleurs, la pulsatilité impose deux contraintes majeures qui ont été résolues de manière astucieuse au cours de l’évolution.
- Au niveau du circuit veineux, l’oreillette est un réservoir-tampon qui permet de passer d’un retour continu à une éjection cyclique ;
- Au niveau du circuit artériel, l’élasticité des grandes artères et les résistances artériolaires élevées sont des moyens de dépulser le flux de manière à ce qu’il devienne aussi continu que possible au niveau capillaire. Chez l’homme, on sait qu'une pulsatilité artérielle élevée restreint la longévité, puisque la valeur de la pression pulsée (PAsyst – PAdiast) est le facteur le plus directement lié aux complications cardiovasculaires [11]. Il semble bien que l’arbre artériel se soit développé de manière à absorber la pulsatilité systolique et à tamponner les variations systolo-diastoliques en périphérie.
Les coronaires n’apparaissent que lorsque la pression ventriculaire et le métabolisme basal sont élevés. Chez les poissons et les amphibiens, le myocarde est majoritairement de type trabéculé ; il est perfusé par des canaux transpariétaux issus de la cavité ventriculaire ; leur flux est assuré par la compression-relaxation exercée par les fibres musculaires. Chez les reptiles et les sauriens, la proportion de myocarde compact s’accroît dans la zone sous-épicardique. Chez les oiseaux et les mammifères, tout le myocarde est de type compact. C’est pour vasculariser ce dernier type de myocarde que le réseau coronaire s’est développé chez ces animaux.
Conclusions
Le cœur tel que nous le connaissons paraît donc un aboutissement logique de l’évolution pour des animaux à sang chaud, mais il serait vain de penser que les mammifères sont les rois de la nature. Même s’ils affichent les records de poids, ce ne fut pas toujours le cas : les dinosaures étaient bien plus grands que les éléphants. Ils ne dominent pas non plus par le nombre: il en existe à peine plus de 4'000 espèces, alors qu’il y a 9'700 espèces d’oiseaux, 7'000 espèces de reptiles, 45'000 espèces de poissons, et que les arthropodes (insectes, arachnides, myriapodes et crustacés) représentent environ un million et demi d’espèces différentes [9]. Le succès des mammifères supérieurs tient probablement à leur polyvalence et aux prestations de leur cerveau. Toutefois, les êtres complexes sont l’exception dans la nature, dont la plus grande masse animale est constituée de bactéries, de protozoaires et de cnidaires. Ce qu’on dessine comme un arbre de l’évolution dirigé vers les mammifères supérieurs (voir ci-dessus Figure 5.36) est en réalité un buisson immense et touffu, dont émergent quelques branches frêles dont le seul mérite est de produire quelques jolies fleurs.
Les modifications progressives de l’appareil circulatoire montrent que tous les embranchements des animaux évoluent en fonction des mêmes contraintes et aboutissent à des résultats similaires, un phénomène appelé convergence. Chaque phylum développe des espèces de plus en plus sophistiquées marquées par une augmentation constante du métabolisme, de la complexité et de l’indépendance vis-à-vis de l’environnement. Pour chaque espèce, le succès tient à un équilibre réussi entre sa spécialisation ou sa complexité d’une part, et sa flexibilité ou sa robustesse de l’autre.
| L'hémodynamique dans l'évolution animale |
| L’augmentation progressive des besoins métaboliques pousse à accroître constamment la pression systémique. Dès que celle-ci dépasse 50 mmHg, on voit apparaître une circulation séparée à basse pression pour les échanges gazeux. La chambre contractile (ventricule) est le système de pompe le plus performant, mais il implique une pulsatilité périphérique. Plusieurs types de cœur existent dans la nature: tubes péristaltiques (vers), cœurs en série montés sur l'aorte (insectes), chambre contractile unique (crustacés), cœur à deux chambres (une oreillette et un ventricule, chez les mollusques et les poissons), cœur à trois chambres (deux oreillettes et un ventricule, chez les amphibiens), cœur à quatre cavités et deux circulation séparées (oiseaux, mammifères). Chez les mammifères, le cœur représente 0.6% de la masse corporelle. La fréquence cardiaque de base est directement proportionnelle à la consommation d'O2 et inversement proportionnelle à la taille. |
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- BADIWALA MV, RAO V. Left ventricular device as destination therapy: are we there yet ? Curr Opin Cardiol 2009; 24:184-9
- BETTEX DA, PRÊTRE R, CHASSOT PG. Is our heart a well-designed pump ? The heart along animal evolution. Eur Heart J 2014; 35(34): 2322-32
- BISHOPRIC NH. Evolution of the heart from bacteria to man. Ann N Y Acad Sci 2005; 1047:13-9
- COOK S, TOGNI M, SCHAUB MC, WENEWESER P, HESS OM. High heart rate: a cardiovascular risk factor ? Eur Heart J 2006; 27:2387-93
- DEMBITSKY W. 3rd World Congress on Biomimetics, Artificial Muscles & Nano-Bio. CHUV-EPFL, Lausanne, 2006
- HEAD BP, GRAHAM JB, SHABETAI R, LAI NC. Regulation of cardiac function in the horn shark by changes in pericardial fluid volume mediated through the pericardioperitoneal canal. Fish Physiol Biochem 2001; 24:141-8
- JENSEN B, NYENGAARD JR, PEDERSEN M, WANG T. Anatomy of the python heart. Anat Sci Int 2010; 84(4):194-203
- KILNER PJ, YANG GZ, FIRMIN DN. Morphodynamics of flow through sinuous curvatures of the heart. Biorheology 2002; 39(3-4): 409-17
- LAVERS C. Why elephants have big ears ? London:Phoenix, 2003
- MOORMAN AFM, CHRISTOFFELS VM. Cardiac chamber formation: development, genes, and evolution. Physiol Rev 2003; 83:1223-67
- O’ROURKE MF, SAFAR ME. Relationship between aortic stiffening and microvascular disease in brain and kidney. Cause and logic of therapy. Hypertension 2005; 46:200-4
- SIMÕES-COSTA MS, VASCONCELOS M, SAMPAIO AC, et al. The evolutionary origin of cardiac chambers. Develop Biol 2005; 277:1-15
- SCHMIDT-NIELSEN K. Animal physiology. Adaptation and environment. 5th edition. Cambridge, Cambridge University Press, 2002, 91-125
- SLÁMA K. A new look at the comparative physiology of insect and human hearts. J Insect Physiol 2012; 58:1072-81
- SLAUGHTER MS, ROGERS JG, MILANO CA, et al. Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med 2009; 361:2241-51
