Affichage spectral
Lorsque la structure heurtée par le rayon d'ultrasons qui l'interroge est en mouvement, elle renvoie un écho avec un décalage de fréquence positif si elle se rapproche ou négatif si elle s'éloigne; c'est l'effet Doppler. La différence entre la fréquence d'émission et la fréquence de réception permet de calculer la vitesse de déplacement de la cible. En mesurant celle des globules, on peut mesurer la vélocité du flux sanguin. Celle-ci est affichée à l'écran sous la forme du spectre des vélocités au cours du temps d'observation (Doppler spectral) et donne une représentation du flux sanguin à travers la structure observée. On dispose de deux modalités techniques (Figure 25.17).
- Doppler pulsé: l'analyse Doppler a lieu à un endroit précis le long de l'axe d'interrogation; la position de la fenêtre d'échantillonnage (sampling volume) est réglée par l'observateur. Cet avantage se double d'un inconvénient: la vélocité maximale enregistrable est limitée (0.6-1.2 m/s selon la profondeur).
- Doppler continu: l'analyse Doppler a lieu tout au long de l'axe d'interrogation et enregistre la totalité des vélocités rencontrées sur cet axe; seul l'observateur sait à quel endroit a lieu la vélocité maximale affichée. Cet inconvénient est compensé par l'absence de limite à la vélocité maximale enregistrable.

Figure 25.17 : Exemples d’affichage Doppler spectral. A : flux veineux pulmonaire au Doppler pulsé avec ses deux composantes systolique (S) et diastolique (D) ; il apparaît au-dessus de la ligne de base parce que le flux se dirige vers le capteur; il présente une enveloppe très mince parce que le flux est laminaire et homogène. B : flux veineux pulmonaire au Doppler pulsé ; le flux est inhomogène et l’image spectral ne présente pas d’enveloppe nette mais un tracé presque plein, indiquant à la présence d’une grande variétés de vélocités différentes. C : flux d’une sténose aortique au Doppler continu ; il est situé en dessous de la ligne de base puisque le flux s’éloigne du capteur oesophagien situé en position transgastrique. La vélocité maximale est 4.7 m/s. On voit en superposition le vélocité dans la chambre de chasse du VG (Vmax 1.2 m/s), parce que le Doppler continu enregistre toutes les vélocités dans son axe de mesure.
Doppler couleur
Le Doppler couleur est une variante du Doppler pulsé dans laquelle la direction du flux est traduite par un code couleur et la vélocité par l'intensité de cette couleur. Le flux accéléré ou tourbillonnaire prend un aspect en mosaïque multicolore. Le flux couleur est la manière la plus simple de visualiser une insuffisance valvulaire et de démontrer l'accélération à travers une sténose. Au repos, le flux sanguin est physiologiquement laminaire dans les cavités cardiaques, donc silencieux. Toute présence de tourbillon indique une accélération pathologique : sténose valvulaire, régurgitation d'une cavité à haute pression dans une cavité à basse pression, simple éréthisme cardiaque ou turbulence localisée au voisinage d’une sclérose. Les vortex de ces tourbillons induisent des perturbations visibles à l’échocardiographie Doppler. Le flux couleur donne lieu à un phénomène appelé recouvrement spectral, ou aliasing, qui consiste en une inversion du code couleur lorsque la vitesse du flux dépasse la cadence d'enregistrement du dispositif. Ce phénomène est analogue à la rotation lente en sens inverse qui apparaît au cinéma lorsque la vitesse de rotation d'une roue (nombre de tours par seconde) devient supérieure à la cadence d'enregistrement de la caméra (nombre d'images par seconde).
L'affichage du flux couleur permet une évaluation rapide et aisée du flux dans les valvulopathies, mais il présente des limites qu'il est capital de connaître pour éviter des mésinterprétations dangereuses (Figure 11.25 et Figure 11.26).
- L'image du flux couleur est une cartographie des vélocités mais non une représentation du volume sanguin réel. Or la vélocité d'un flux est l'expression du gradient de pression instantané entre la cavité d'amont et la cavité d'aval; par exemple, la Vmax d'une insuffisance mitrale (IM) diminue si la fonction ventriculaire gauche est abaissée, la Vmax d'une insuffisance aortique (IA) augmente si les RAS sont élevées.
- Pour la même pression d'amont, la vélocité du flux est inversement proportionnelle à la dimension de l’orifice: elle diminue si l'orifice est très large.
- L’imagerie bidimensionnelle réalise une tomographie et n’affiche la dimension du jet que dans un plan; alors que des jets centraux ont en général une symétrie circulaire, les jets excentriques qui butent contre une paroi ont une géométrie très variable qui n’apparaît pas dans le plan de coupe (Vidéos). Le jet couleur bidimensionnel donne une représentation fiable des premiers, mais tend à sous-estimer l'importance des seconds parce qu'il ne visualise par leur étendue dans l'espace.
Vidéo: Insuffisance mitrale centrale de type I.
Vidéo: Insuffisance mitrale excentrique de type II due à un prolapsus du feuillet postérieur; le jet est dirigé vers le septum interauriculaire. - Un jet d'IM centrale de haute vélocité (Vmax 5-6 m/s) recrute du volume sanguin déjà dans l'OG par effet Venturi, alors qu'un jet d'IM excentrique ralentit lorsqu'il se freine contre la paroi de l'OG et n'est pas amplifié par l'effet Venturi. Le jet couleur tend de nouveau à surestimer l'importance des premiers mais à sous-estimer celle des seconds [4].
- L'effet Doppler est maximal lorsque le flux et l'axe d'interrogation ont la même direction. Le jet d'une IM présente un développement maximal en vues mi-oesophagiennes rétro-cardiaques parce que son flux est bien aligné avec l'axe du Doppler, alors que le jet d'une IA est le plus important en vues transgastriques où il est orienté en direction du capteur.
- La mesure de vélocité maximale doit être faite à l'endroit le plus rétréci, c'est-à-dire entre les feuillets de la valve ou immédiatement en aval de celle-ci (vena contracta), mais non à distance; ceci est valable aussi bien pour le jet d'une une sténose que pour celui d'une insuffisance.
- L'imagerie présuppose intuitivement que les orifices sont circulaires, mais ceux-ci se présentent souvent sous forme d'ovale, de fente ou de géométrie complexe; il est donc capital de toujours procéder à une évaluation dans au moins deux plans orthogonaux.
- Dans une insuffisance, le volume régurgité dépend de la durée du flux; si celui-ci est bref, l'insuffisance est bien moins importante que s'il est pansystolique (IM) ou pandiastolique (IA).
- L'échelle de mesure (limite de Nyquist) doit être adaptée à la vélocité du flux mesuré; si elle est trop basse, des tourbillons apparaissent dans tout le secteur, mais si elle est trop élevée, les flux lents ne sont plus représentés.
- Le gain doit être réglé de manière à faire juste disparaître les petites taches colorées qui apparaissent en-dehors des cavités cardiaques et des vaisseaux lorsqu’il est excessif (ce réglage est automatisé dans la plupart des machines).

Figure 11.25 : Imagerie échocardiographique en mode Doppler. A : insuffisance mitrale en vue long-axe du VG ; le faisceau Doppler (traitillé) est bien dans l’axe du flux de l’IM représentée par le flux Doppler couleur. B : représentation schématique du faisceau Doppler à travers une sténose aortique par voie transgastrique ; pour analyser de manière cohérente le flux à travers la sénose, l’axe du Doppler doit traverser la zone d’accélération pré-sténotique (PISA), l’orifice rétréci avec la vena contracta (flux laminaire, flèche rouge) à sa sortie, et la zone des turbulences dans la racine de l’aorte ; la vélocité maximale du flux est enregistrée au niveau la vena contracta.


Figure 11.26 : Insuffisance mitrale (IM) en vue ETO 4-cavités (0°). A : IM concentrique, de symétrie circulaire ; ce type de régurgitation a la même apparence dans tous les plans. Comme l’IM (Vmax 5-6 m/s) recrute du sang déjà dans l’OG par effet Venturi et qu’elle est dirigée vers le capteur, l’étendue du jet couleur tend à surestimer l’importance du volume régurgité. Dans le cas présent, l’IM est de degré mineure-à-modérée, car elle est fine à son origine et ne présente pas de zone d’accélération concentrique (PISA) sur le versant venriculaire. B : IM excentrique sur prolapsus du feuillet postérieur. Cette IM se freine lorsqu’elle bute contre la paroi de l’oreillette, n’a que peu d’effet Venturi et présente une image très différente selon les plans d’analyse ; en effet, elle s’étale sur une grande partie de la paroi de l’OG, mais l’image est toujours une tomographie et ne fait qu’une coupe de ce large jet. De ce fait, l’image couleur sous-estime l’importance de la régurgitation. Dans le cas présent, il s’agit d’une IM sévère comme le prouvent la largeur de la vena contracta (flèche jaune) et la présence d’un important PISA sur le versant ventriculaire.
Vena contracta
Dans un rétrécissement, le flux tend à couler dans la partie centrale car les zones externes sont freinées par le frottement contre les parois. Le flux est laminaire et le reste à sa sortie ; il ne devient turbulent qu'à quelque distance. Son plus petit diamètre n’est pas dans l’orifice lui-même, mais juste après, à un endroit appelé en hydrodynamique vena contracta (Figure 11.27) [14,15]. Comme le flux sanguin y est encore laminaire, la dimension de cette zone reproduit fidèlement la forme du flux dans la sténose, mais sa surface de section est légèrement plus petite que celle de l'orifice anatomique (GOA, geometrical orifice area). La mesure du diamètre de la vena contracta est une excellente technique pour évaluer la dimension de l’orifice effectif d'une sténose ou d'une régurgitation valvulaire (EOA, effective orifice area), car elle est indépendante de la vitesse du flux et de la pression motrice. De ce fait, elle garde sa valeur dans les insuffisances aiguës, où l’absence de dilatation de la cavité d’aval conduit à une rapide égalisation des pressions et où la dysfonction ventriculaire diminue la vélocité du jet, donc sa surface apparente. La dimension de la vena contracta est mieux corrélée à l'impact hémodynamique et au pronostic que la surface anatomique de l'orifice. L'insuffisance est sévère lorsque le diamètre de la vena contracta est > 0.7 cm dans le cas d’une IM ou d'une IT, et > 0.6 cm dans le cas d'une IA.
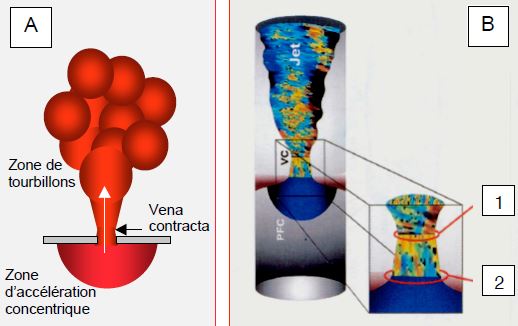

Figure 11.27 : Zone d’accélération concentrique proximale (proxinal isovelocity surface area ou PISA) et vena contracta illustrées dans une insuffisance mitrale en vue mi-oesophagienne rétrocardiaque. A : représentation schématique ; le PISA est un hémisphère concentrique centré sur l’orifice et situé dans la chambre d’amont du flux ; la vena contracta est la zone la plus étroite du flux laminaire qui sort du rétrécissement. B: La section de la vena contracta (1) est un peu plus petite que celle de l'orifice anatomique (2). C : En accélérant progressivement en direction de l’orifice, le flux Doppler franchit la limite de Nyquist (aliasing) et change de couleur ; il passe de l’extrémité jaune de l’échelle de couleur à l’extrémité bleue (E). Plus le volume de sang à faire passer par l’orifice est élevé, plus la dimension du PISA est grande. D: Insuffisance mitrale mineure-à-modérée: Le PISA est minuscule, la vena contracta est étroite. E : image d’une insuffisance mitrale sévère ; lorsque l’échelle de couleur est réglée à 35-50 cm/s (ici 41 cm/s), un rayon de 1er aliasing de 1 cm (flèche blanche) correspond à une surface de l’orifice de régurgitation de 0.5 cm2 (IM sévère). La principale difficulté de cette mesure est définir avec exactitude le plan de l'orifice de régurgitation au niveau des feuillets.
PISA
Lorsqu’elles doivent passer d’une cavité large à un orifice étroit, les molécules de fluide accélèrent en une zone concentrique en amont du rétrécissement, puisque les fluides sont incompressibles (Vidéos). Cette zone de convergence hémisphérique est d’autant plus grande que l’accélération est élevée, donc que la quantité de liquide qui doit transiter par l’orifice est importante. Cette zone est appelée proximal isovelocity surface area, ou PISA, parce que la vitesse du fluide est la même sur la toute la surface de chaque hémisphère concentrique successif (voir Chapitre 25, Zone d'accélération concentrique) [6,13]. Selon l’équation de continuité, le produit de la vélocité (V) à la surface d’un hémisphère et de la surface (S) de cet hémisphère est égal au produit de la vélocité maximale à travers l’orifice et de la surface de ce dernier : (S • V)hémisphère = (S • V)orifice .
Vidéo: zone d'accélération concentrique (PISA) côté ventriculaire d'une insuffisance mitrale centrale; en accélérant, le flux passe du rouge au jaune puis au bleu.
Vidéo: Zone d'accélération concentrique (PISA) sur la face ventriculaire d'un orifice de régurgitation mitrale (prolapsus du feuillet postérieur).
Il est facile de mesurer la surface de l’hémisphère concentrique en repérant la limite à laquelle a lieu l’inversion de couleur du flux. Cette inversion (aliasing) survient lorsque la Vmax du flux dépasse celle qui est lisible pour l’échelle couleur choisie. Pour une insuffisance mitrale:
S orifice de régurgitation = (Shémisph • Valiasing) / VmaxIM = (2 π r2 • Valiasing) / VmaxIM
Dans l’insuffisance mitrale, on peut simplifier le calcul : si l’échelle de couleur est réglée sur une vélocité d’aliasing de 50 cm/s, un rayon de 1 cm pour l’hémisphère de 1er aliasing équivaut à un orifice de régurgitation ≥ 0.5 cm2, ce qui correspond à une IM sévère [7,11,12].
Débit cardiaque
Le volume systolique est le produit de la surface de section (S) mesurée en imagerie bidimensionnelle et de l'intégrale des vélocités (ITV) mesurées par effet Doppler au même endroit, soit : VS = S (cm2) • ITV (cm). En multipliant le résultat par la fréquence cardiaque (FC), on obtient le débit cardiaque :
Q (ml/min) = S (cm2) • ITV (cm) • FC (min-1)
Ce calcul peut se faire à de nombreux endroits, mais il est plus précis lorsque la section locale est circulaire (CCVG) ou de forme géométrique simple (triangulaire pour la valve aortique), et ne se modifie pas au cours de l’éjection [5]. La vélocité et le diamètre doivent être mesurés strictement au même endroit et en systole. Malheureusement, ils ne peuvent pas être mesurés simultanément, puisqu’ils requièrent des angles de vue différents ; ce point introduit un biais significatif dans les mesures.
- CCVG : mesure du diamètre (moyen : 2.0-2.2 cm) en 4-cavités ou en long-axe rétrocardiaques mi-oesophage ; mesure du flux par voie transgastrique profonde (long-axe 0° ou 120°) au Doppler pulsé. L’écho 3D révèle que les mesures bidimensionnelles de la CCVG sous-estiment sa surface, qui est elliptique et non circulaire [10].
- Valve aortique : mesure de la surface dans son ouverture triangulaire mésosystolique (vue basale rétrocardiaque court axe 40°) ; mesure du flux par voie transgastrique (long-axe 0° ou 120°) au Doppler continu. La valve aortique ne présente une ouverture circulaire qu’en protosystole ; elle a une forme triangulaire pendant plus des 2/3 de la systole (S = 0.433 • L2).
- Valve mitrale : mesure de la surface d’ouverture (S = 0.785 • D2) par la moyenne du diamètre de l’anneau à 60° et à 120° rétrocardiaque en protodiastole ; mesure du flux au Doppler pulsé en positionnant la fenêtre au niveau de l’anneau mitral (et non à l’extrémité des feuillets). C'est la mesure la moins fiable.
- Le débit cardiaque droit se mesure à travers la CCVD (vue transgastrique 40° ou 100°) ou à travers l’artère pulmonaire (vue court axe aorte ascendante 0-20°) ; mesurer le diamètre de l’AP en systole et le flux au Doppler pulsé strictement au même niveau.
- L'échocardiographie 3D mesure le volume du VG en systole et en diastole de manière assez fiable; par la soustraction Vtd – Vts on obtient le volume systolique.
L'ETO est cependant beaucoup moins performant que la Swan-Ganz pour le calcul du débit cardiaque ; les meilleurs résultats, obtenus au niveau de la valve aortique en considérant sa géométrie comme triangulaire, restent en-dehors de la limite d’agrément de 30% avec la thermodilution pulmonaire [3].
Doppler tissulaire
Le Doppler tissulaire permet d'observer et de quantifier la vitesse de déplacement des structures anatomiques en systole et en diastole. La descente de l'anneau mitral vers l'apex en systole est due à la contraction longitudinale du VG. Celle-ci est le fait des faisceaux myocardiques longitudinaux-obliques situés dans le sous-endocarde, qui est précisément la zone la plus à risque en cas de surcharge ou d'ischémie. Lorsqu'elle est abaissée (valeur normale de S': 10-12 cm/s), elle est un signe de dysfonction ventriculaire plus fin et plus précoce que la chute de la fraction d'éjection. Le Doppler tissulaire peut également évaluer une portion du myocarde et mesurer sa déformation en systole et en diastole (strain) ainsi que la vitesse de cette déformation (strain rate) [2].
Speckle-tracking
L’hétérogénéité des échos du myocarde permet d’isoler de petites zones de 20-40 pixels, appelées speckle, présentant une configuration particulière dans leur réflexion des ultrasons qui ne se modifie pas au cours du cycle cardiaque. Au moyen d’algorithmes de reconnaissance de forme, le processeur peut suivre les déplacements de ces marqueurs acoustiques naturels ; c’est le speckle-tracking (voir Figure 25.31). En suivant plusieurs d’entre eux, l’ordinateur peut évaluer en continu la distance qui les sépare et la déformation du segment de tissu observé (strain et strain rate) [2]. Ce type d'investigation permet de quantifier des dégradations fines de la fonction du VG, comme par exemple son degré de raccourcissement longitudinal, qui ne sont pas apparente dans la fraction d'éjection [1].
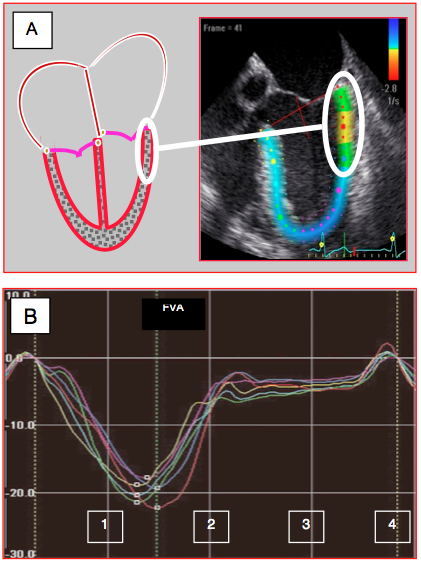
Figure 25.31 : Technologie du speckle-tracking. A: L’inhomogénéité de la structure myocardique permet de suivre les déplacements de petits granules de 20-40 pixels (speckle) présentant une configuration stable au moyen d’algorithmes de reconnaissance de forme ; ces zones se modifiant peu entre la systole et la diastole, on peut les marquer (points de couleur) et quantifier ainsi la cinétique tissulaire indépendamment des mouvements de translation et de rotation du ventricule. Contrairement au Doppler tissulaire, le speckle-tracking est indépendant de l’angle existant entre l’axe du mouvement et celui des ultrasons. B: courbes de déformation longitudinale (strain) obtenues dans 6 segments du VG en vue 4-cavités; chaque segment est représenté par un trait de couleur différente. Dans ce cas, la contraction est homogène. 1: contraction systolique. 2: relaxation. 3: diastasis. 4: contraction auriculaire. FVA: fermeture de la valve aortique [D'après: Feigenbaum H et al. A practical approach to using strain echocardiography to evaluate the left ventricle. Circ J 2012; 76:1550-5].
Discordances
Les différentes modalités d'examen échocardiographiques ne donnent pas toujours des résultats homogènes. Dans la sténose aortique serrée, par exemple, les inconsistances entre le gradient, la vélocité et la surface surviennent dans 30% des cas [8]. De nombreux artéfacts (reverbérations et ombres de calcifications ou de prothèses) et des difficultés techniques (mauvais alignement de l'axe Doppler et du flux sanguin) conduisent fréquemment à une sous-estimation des lésions valvulaires. Il est donc important de ne pas fonder un diagnostic ou une indication opératoire exclusivement sur l'échocardiographie, mais de corréler cette dernière avec d'autres moyens d'investigation (CT multibarrettes, IRM) et surtout avec la clinique dont souffre le patient [9]. La fraction d'éjection est un élément trompeur pour l'estimation de la fonction du VG dans le cadre des valvulopathies, car elle dépend des conditions de charge - précharge et postcharge sont anormales dans les maladies valvulaires - et son calcul est tributaire de la forme et des dimensions du VG, qui peuvent être très altérées.
| Doppler couleur |
|
L’extension du jet couleur d’une insuffisance valvulaire ne représente pas le volume régurgité ; elle est une cartographie des vélocités, qui est elle-même fonction de :
- Echelle de couleur (limite de Nyquist) et gain
- Gradient de pression à travers la valve
- Dimension de l’orifice
Le jet couleur surestime l’insuffisance en cas de : jet central, haute pression d’amont, petit orifice.
Le jet couleur sous-estime l’insuffisance en cas de : jet excentrique, basse pression motrice, orifice très large.
Valvulopathies : recommandations pour l’analyse Doppler
Axe du Doppler bien dans l’axe de l’insuffisance ou de la sténose, au travers de l’orifice valvulaire.
Bon déroulement anatomique de la cavité d’aval dans l’axe du Doppler.
Analyse de la Vmax au niveau de la vena contracta.
Mesure dans 2 plans orthogonaux.
Cohérence des résultats avec les mesures 2D (orifice de régurgitation) et avec le remodelage des cavités.
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- ADDA J, MIELOT C, GIORGI R, et al. Low flow/low gradient severe aortic stenosis despite normal ejection fraction is associated with severe left ventricular dysfunction as assessed by speckle-tracking echocardiography: a multicenter study. Circ Cardiovasc Imaging 2012; 5:27-35
- BAX JJ, DELGADO V. Advanced imaging in valvular heart disease. Nat Rev Cardiol 2017; 14:209-23
- BETTEX DA, HINSELMANN V, HELLERMANN JP, JENNI R, SCHMID ER. Inaccuracy of cardiac output determination by transoesophageal echocardiography. Anaesthesia 2004; 59:1184-92
- CAPE EG, YOGANATHAN AP, WEYMAN AE, LEVINE RA. Adjacent solid boundaries alter the size of regurgitant jets on Doppler color flow maps. J Am Coll Cardiol 1991; 17:1094-102
- DARMON PL, HILLEL Z, MOGTADER A, et al. Cardiac output by transesophageal echocardiography using continuous-wave Doppler across the aortic valve. Anesthesiology 1994; 80:796-805
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- MATSUMARA Y, FUKUDA S, TRAN H. Geometry of the proximal isovelocity surface area in mitral regurgitation by 3-dimensional color Doppler echocardiography: difference between functional mitral regurgitation and prolapse regurgitation. Am Heart J 2008; 155:231-8
- MINNERS J, ALLGEIER M, GOHLKE-BAERWOLF C, et al. Incosistent grading of aortic valve stenosis by current guidelines: haemodynamic studies in patients with apparently normal left ventricular function. Heart 2010; 96:1463-8
- NISHIMURA RA, CARABELLO BA. Operationalizing the 2014 ACC/AHA Guidelines for valvular heart disease. J Am Coll Cardiol 2016; 67:2289-94
- POH KK. Assessing aortic valve area in aortic stenosis by continuity equation: a novel approach using real-time three-dimensional echocardiography. Eur Heart J 2008; 29:2526-35
- PU M, VANDERVOORT PM, GRIFFIN BP, et al. Quantification of mitral regurgitation by the proximal convergence method using transesophageal echocardiography. Clinical validation of a geometric correction for proximal flow constraint. Circulation 1995; 92:2169-77
- ROSSI A, DUJARDIN KS, BAILEY KR, et al. Rapid estimation of regurgitant volume by the proximal isovelocity surface area method in mitral regurgitation: Can continuous-wave Doppler echocardiography be omitted ?. J Am Soc Echocardiogr 1998; 11:138-48
- SIMPSON IA, SHIOTA T, GHARIB M, et al. Current status of flow convergence for clinical applications: Is it a leaning tower of “PISA” ? J Am Coll Cardiol 1996; 27:504-9
- TRIBOUILLOY C, SHEN WF, QUERE JP, et al. Assessment of severity of mitral regurgitation by measuring regurgitant jet width at its origin with transesophageal Doppler color flow imaging. Circulation 1992; 85:1248-53
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developed in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
