La CIA représente le 7% des anomalies congénitales de l’enfant. C’est la deuxième cardiopathie congénitale la plus fréquente après la CIV. Le septum interauriculaire peut présenter cinq types de défauts (Figure 14.36) [5].

Figure 14.36 : Vue du septum interauriculaire depuis l'OD, avec l’emplacement des différentes possibilités anatomiques de communications interauriculaires [3].
- Ostium secundum situé au centre du septum au niveau de la fosse ovale, représentant 75% des cas;
- Ostium primum: défaut situé près de la valve tricuspide, qui fait partie du canal atrio-ventriculaire (15% des cas);
- Sinus venosus situé à l'origine d'une veine cave (le plus fréquement la VCS), souvent associé à un retour veineux pulmonaire anormal partiel (5-10% des cas);
- Absence de toit du sinus coronaire qui le met en communication avec l'OG (< 1%);
- Cas particulier: foraman ovale perméable (FOP).
Le débit du shunt G-D est fonction de la taille de la CIA et de la compliance respective des cavités droites et gauches: lorsque celle du VG baisse, la POG s'élève et le shunt G-D augmente, parce que le flux du shunt est majoritairement diastolique. Il conduit à une surcharge de volume à droite, donc à une dilatation de l'OD, du VD et de l'AP (Figure 14.37).

Figure 14.37 : Communication interauriculaire. Schéma de la silhouette des 4 chambres cardiaques en cas de CIA avec un shunt gauche → droit important (flèche). L'OD et le VD sont dilatés; le VD est hypertrophié. L’apex du cœur est formé par le VD, non par le VG. La dilatation du VD entraîne secondairement une insuffisance tricuspidienne.
Le VD est dilaté et hypertrophié pour accommoder la surcharge de volume (Vidéo).
Vidéo: Hypertrophie dilatative majeure du VD par surcharge de volume due à une communication interauriculaire (vue transgastrique court-axe); le VD (à gauche sur l'écran) est considérablement plus grand que le VG (à droite sur l'écran).
Le diamètre de l'AP est plus grand que celui de l'aorte, et le flux y est accéléré (voir Figure 15.11). Le rapport normal de 0.6 entre les dimensions droites et gauches et entre la vélocité de l'AP et celle de l'aorte est plus que doublé. Si elle survient, l’HTAP est un phénomène tardif (> 20 ans) ; il est exceptionnel que les RAP dépassent 500 dynes•s•cm-5. Contrairement à la communication interventriculaire, la CIA ne transmet pas la pression artérielle systémique à l'arbre pulmonaire.
Vidéo: Hypertrophie dilatative majeure du VD par surcharge de volume due à une communication interauriculaire (vue transgastrique court-axe); le VD (à gauche sur l'écran) est considérablement plus grand que le VG (à droite sur l'écran).
Le diamètre de l'AP est plus grand que celui de l'aorte, et le flux y est accéléré (voir Figure 15.11). Le rapport normal de 0.6 entre les dimensions droites et gauches et entre la vélocité de l'AP et celle de l'aorte est plus que doublé. Si elle survient, l’HTAP est un phénomène tardif (> 20 ans) ; il est exceptionnel que les RAP dépassent 500 dynes•s•cm-5. Contrairement à la communication interventriculaire, la CIA ne transmet pas la pression artérielle systémique à l'arbre pulmonaire.
Le flux à travers le shunt a un aspect biphasique typique (Vmax 0.5-1.5 m/s): il présente un pic télésystolique – protodiastolique correspondant à l'onde "v" et un pic durant la contraction auriculaire correspondant à l'onde "a" (Vidéo).
Vidéo: Shunt gauche - droit au flux couleur entre l'OG (en-haut) et l'OD (en-bas) dans une CIA.
Entre deux, il existe deux périodes pendant lesquelles le flux est ralenti, voire renversé; elles correspondent aux descentes de pression "x" et "y" (Figure 14.38) [9].
Vidéo: Shunt gauche - droit au flux couleur entre l'OG (en-haut) et l'OD (en-bas) dans une CIA.
Entre deux, il existe deux périodes pendant lesquelles le flux est ralenti, voire renversé; elles correspondent aux descentes de pression "x" et "y" (Figure 14.38) [9].

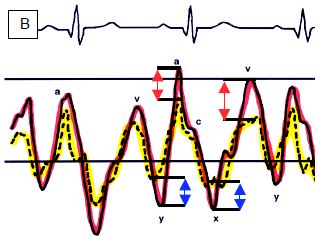
Figure 14.38 : Représentations spectrales du flux à travers une CIA; le shunt est à large prédominance gauche - droit (flux en dessous de la ligne de base, s'éloignant du capteur situé dans l'oesophage), avec deux composantes (flèches rouges); il présente aussi deux petites composantes droite - gauche au-dessus de la ligne de base (flèches vertes). Représentation des courbes de pression de l'OG (rouge) et de l'OD (jaune). Les variations de pression sont plus amples à gauche. De ce fait, la POG est plus élevée que la POD lors des pics de pression, mais plus basse lors de nadirs de pression. Le flux sera donc gauche - droit pendant les ondes a et v (flèches rouges), mais droite - gauche pendant les descentes x et y (flèches bleues) [8,9].
Cette morphologie est liée à l'évolution des pressions dans les oreillettes au cours du cycle cardiaque [8]. En effet, l'amplitude des variations de pression est plus grande dans l'OG que dans l'OD: la pression est donc plus élevée à gauche qu'à droite pendant les pics de pression, mais plus basse pendant les nadirs de pression, ce qui permet une inversion du flux à ce moment. Le renversement le plus significatif a lieu en systole, car la descente de l'anneau mitral provoque une augmentation brusque du volume de l'OG et une diminution importante de sa pression. La composante D-G du shunt s'accentue lorsque le remplissage de l'OD augmente à la faveur d'une chute de la pression endothoracique (relaxation après Valsalva, manoeuvre de Müller); il en est de même lorsque la POD augmente parce que la postcharge et la pression de remplissage du VD s'élèvent, comme pendant un inspirium en IPPV ou une PEEP (Figure 14.39) [7].
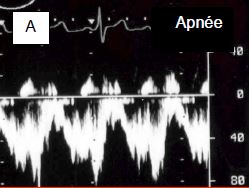
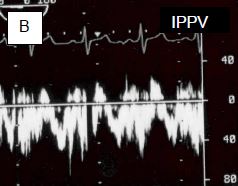
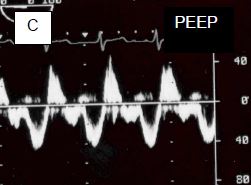

Figure 14.39 : Effet de la ventilation sur le flux d'une CIA. A : En apnée, le flux est presque exclusivement gauche - droit. B : En IPPV, la vélocité du flux gauche – droit diminue. C : L'adjonction de 10 cm H2O de PEEP réduit encore la composante gauche - droite, et augmente la composante droite - gauche. Bien que la lésion ne soit pas cyanogène, la saturation artérielle va baisser. D : Une embolie paradoxale peut survenir dans les moments où la POD est plus élevée que la POG, comme l'indique le passage de microbulles de l'OD dans l'OG en présence de PEEP (flèche verte : CIA).
Ainsi même un shunt à prédominance G-D peut occasionner une embolie paradoxale à la faveur d'une manoeuvre de Valsalva ou d'une PEEP excessive. En anesthésie, ceci oblige à une "chasse aux bulles" dans toutes les voies veineuses pour éviter des embolies gazeuses cérébrales ou coronaires.
Une petite CIA peut rester asymptomatique fort longtemps; le seul indice est un souffle systolique 3/6 de haut débit à travers la valve pulmonaire, que l'on entend au bord supérieur gauche du sternum, et un deuxième bruit dédoublé et fixe. Les CIA de < 5 mm sans signes de surcharge droite ni d’HTAP n’ont pas besoin d’être opérées. Les CIA associées à une augmentation de plus de 50% du flux pulmonaire (Qp : Qs > 1.5), à des embolies paradoxales et à une dilatation droite doivent être fermées afin de prévenir les arythmies (tachyarythmies sus-jonctionnelles) et la décompensation ventriculaire droite. Il n'y a pas de séquelles si l'opération a lieu avant 4-5 ans, alors que l’hypertrophie ventriculaire droite et la dilatation de l'OD persistent si la correction a lieu au-delà de 5 ans [6]. En présence d’HTAP, la fermeture d’une CIA n’est indiquée que si le shunt est majoritairement G-D et si le rapport RAP/RAS est < 0.3 [2].
Lorsqu'elles sont centrales (ostium secundum ou PFO) et entourées de bords de bonnes dimensions (≥ 5 mm), les CIA de moins de 40 mm sont occluses par une prothèse placée par voie percutanée (occluders Amplatzer™, PFO Star™, Helex™, etc). Ce traitement est réservé aux enfants de > 25 kg avec un Qp/Qs ≥ 1.5 mais sans HTAP [11]. Les principales complications sont les arythmies, les troubles de conduction, la tamponnade, l’embolisation (0.55%) et l’érosion (0.1%); ce dernier point est lié à l’étroitesse du bord septal d’implantation, particulièrement dans la région antéro-suérieure où la prothèse peut éroder l’aorte toute proche [1]. Bien que le taux de ces complication soit ≤ 1%, les résultats à long terme sont satisfaisants [4]. Lorsqu’elles sont grandes, d’un autre type que l’ostium secundum et le FOP ou associées à d’autres malformations cardiaques, les CIA sont fermées chirurgicalement (patch de péricarde autologue ou fermeture directe) par sternotomie ou par mini-thoracotomie droite; la mortalité opératoire est < 1%. Dans les deux abords, l’échocardiographie transoesophagienne est très utile pour diriger l’appareil de fermeture et contrôler l’étanchéité après l’intervention.
Anesthésie
Les enfants porteurs d’une CIA simple sont opérés vers 3-5 ans. Ils sont en général en bonne santé et supportent toute technique d’anesthésie; ils peuvent être extubés à la fin de l’opération ou dans l'heure qui suit.
- Technique d'anesthésie préférentielle: inductiuon par inhalation (sevoflurane) ou intraveineuse (propfol, etomidate, kétamine). Maintien par sevoflurane (1-2%), fentanyl (10-15 mcg/kg), rocuronium (0.6-1.2 mg/kg). Chez les petits enfants, une anesthésie caudale avec de la morphine (70 mcg/kg in 5-10 mL NaCl 0.9% sans préservatif) après l'induction assure une excellente analgésie postopératoire [10].
- La prise en charge hémodynamique vise à réduire l'importance du shunt. On l'obtient par une baisse des résistances artérielles systémiques (RAS) et une légère augmentation des résistances artérielles pulmonaires (RAP) (voir Figure 14.8). Pour autant qu'il n'y ait pas d'HTAP, ceci s’obtient par vasodilatation systémique et discrète hypoventilation (FiO2 0.3, PaCO2 45 mmHg).
- La ventilation en pression positive (IPPV) et, a fortiori la PEEP, élèvent la postcharge du VD; elles freinent la composante G-D du shunt mais augmentent la composante D-G. Lors de shunt partiellement bidirectionnel, elles peuvent induire une désaturation artérielle. Il est alors recommandé de ventiler à basse pression.
- Toute élévation de pression dans l'OD augmente le risque d'embolie paradoxale; celle-ci peut survenir sur thrombo-embolie périphérique ou sur injection intempestive d'air ou de particules par des voies veineuses. Il faut méticuleusement éliminer toute bulle d’air dans les perfusions et utiliser des filtres à bulles sur les voies de perfusion lentes; malheureusement, ces filtres ne permettent pas l’administration de propofol, d’etomidate ou de volume rapide.
- En cas d'HTAP, la ventilation en pression positive augmente encore la postcharge droite. Toutefois, cette augmentation de pression est faible par rapport à la pression pulmonaire au repos; elle représente même une plus faible augmentation de postcharge que chez un individu normal. D'autre part, la ventilation contrôlée permet de baisser les RAP par hyperventilation et hypocapnie (voir Hypertension pulmonaire). La musculature vasculaire pulmonaire est hyper-réactive dans le postopératoire.
- La vasodilatation artérielle systémique baisse les pressions gauches et diminue le volume du shunt G-D. De ce point de vue, l'isoflurane et l'anesthésie loco-régionale rachidienne sont de bons choix. Mais si le shunt est déjà bidirectionnel parce que la surcharge droite a induit une HTAP, c'est la composante D-G du shunt qui va augmenter, et avec elle la désaturation artérielle.
- L'hypovolémie est mal supportée, car le patient a besoin d'un haut volume circulant pour maintenir son débit systémique, vu qu'une partie du volume est obligatoirement séquestrée par le shunt entre l'OD et l'OG via le circuit pulmonaire à basse pression; ceci est d'autant plus marqué que les RAS sont élevées.
- La mesure de PVC est un piètre indice de précharge, car la POD est élevée à cause du shunt et de l'éventuelle insuffisance tricuspidienne.
- Le VD a besoin d'une précharge d'autant plus importante qu'il est hypertrophié. La fonction ventriculaire droite peut être améliorée selon les besoins en augmentant la contractilité et la fréquence (dobutamine, milrinone).
- La fermeture d’une CIA rend le malade brusquement hypervolémique : le volume précédemment "volé" dans le circuit pulmonaire par le shunt et ne circulant qu’entre l’OD et l’OG se retrouve additionné au volume circulant systémique.
- En cas de cure de CIA par thoracotomie droite, l’analgésie post-opératoire peut-être conduite de deux manières: soit par un bloc intercostal sous forme d'une infiltration par le chirurgien de bupivacaïne 0,5% (2,5 mg/kg) ou de ropivacaïne 0,2% (3 mg/kg, 2 mg/kg < 1 an), soit par un bloc paravertébral thoracique unique (single shot) effectué par l'anesthésiste après l’induction ou en fin d’intervention (avant l’extubation) [12].
Les complications les plus habituelles sont les arythmies auriculaires (proportionnelles au degré de dilatation de l'OD), le bloc AV complet (surtout en cas d’ostium primum), un défaut sur le patch (shunt résiduel) et une insuffisance mitrale en cas d'ostium primum. Un ECG hautement pathologique avec surélévation des segments ST dans toutes les dérivations est fréquent mais sans signification clinique.
| Communication interauriculaire (CIA) |
|
Caractéristiques:
- Shunt G → D non cyanogène avec augmentation du débit pulmonaire (Qp ↑, Qp/Qs > 1.5:1)
- Petite composante D → G possible (risque ↑ si HTAP ou ↑ P OD)
- Dilatation des chambres de réception: OD, VD, AP
- Surcharge de volume pour le VD
- HTAP peu fréquente (< 10% des adultes: RAP 300-500 dynes•cm•s-5)
- Indications opératoires: Qp/Qs > 1.5, dilatation du VD, dyspnée d’effort
Prise en charge: diminuer le shunt en baissant les RAS et en augmentant les RAP
Recommandations pour l’anesthésie:
- Vasodilatation avec isoflurane (ou sevoflurane)
- Ventilation: FiO2 0.3, normo- ou discrète hypercarbie, P ventil basse, pas de PEEP
- Hypovolémie mal tolérée à cause de la séquestration de volume dans la circulation pulmonaire
- Eviter toute bulle dans les tubulures (risque de passage D-G), utiliser des filtres à bulles
- Extubation rapide
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- AMIN Z, HIJAZI ZM, BASS JL, et al. Erosion of Amplatzer septal occluder device after closure of secundum atrial septal defects : review of registry of complications and recommendations to minimize future risk. Catheter Cardiovasc Interv 2004 ; 63 :496-502
- BENT ST. Anesthesia for left-to-right shunt lesions. In : ANDROPOULOS DA, et al, eds. Anesthesia for congenital heart disease. Oxford: Blackwell-Futura, 2005, 297-327
- BETTEX D, CHASSOT PG. Transesophageal echocardiography in congenital heart disease. In: BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1186-1212
- CHESSA M, CARMINATI M, BUTERA G, et al. Early and late complications associated with transcatheter occlusion of secundum atrial septal defect. J Am Coll Cardiol 2002; 39:1061-5
- DANIELS SR. Epidemiology. In: LONG WA. Fetal and neonatal cardiology. Philadelphia: WB Saunders, 1990, 430
- DAVLOUROS PA, NIWA K, WEBB G, GATZOULIS MA. The right ventricle in congenital heart disease. Heart 2006; 92(Suppl 1): i27-i38
- JAFFE RA, PINTO FJ, SCHNITTGER I, et al. Aspects of mechanical ventilation affecting interatrial shunt flow during general anesthesia. Anesth Analg 1992; 75:484-8
- LEVIN AR. Atrial pressure-flow dynamics in atrial septal defects (secundum type). Circulation 1968; 37:476-9
- LIN FC, FU M, YEH SH, WU D. Doppler atrial flow patterns in patients with secundum atrial septal defects. Determinants, limitations and pitfalls. J Am Soc Echocardiogr 1988; 1:141-5
- NASR VG, DINARDO JA. The pediatric cardiac anesthesia handbook. Oxford: Wiley-Blackwell, 2017; 83-87
- TABIS J, SHENODA M. Percutaneous treatment of patent foramen ovale and atrial septal defects. J Am Coll Cardiol 2012; 60:1722-32
- TAHARA S, INOUE A, SAKAMOTO H, et al. A case series of continuous paravertebral block in minimally invasive cardiac surgery. JA Clin Rep 2017; 3:45
