Canal AV
Un défaut dans la septation centrale du coeur conduit à une malformation complexe, la canal atrio-ventriculaire ou canal AV (endocardial cushion defect) qui comprend plusieurs défauts d'organogenèse (Figure 27.156) [4].
- Une CIA de type ostium primum.
- Une CIV au niveau de la chambre d’admission (inlet), s’étendant antérieurement au septum membraneux.
- Une valve atrio-ventriculaire commune à 5 feuillets; cette malformation correspond à un orifice central à la base du feuillet septal de la tricuspide et du feuillet antérieur de la mitrale qui y forme une fente (cleft).
- Une insertion septale trop apicale de l'anneau mitral; les valves mitrale et tricuspide sont sur le même plan en long-axe (voir Figure 27.130).
- Une déformation en col-de-cygne de la CCVG, due à la position de l’anneau mitral trop apicale par rapport à l’anneau aortique.

Figure 27.156 : Schéma du canal AV. Il existe une CIA de type ostium primum (flèche horizontale), une CIV périmembraneuse (flèche incurvée), un cleft dans les feuillets septaux de la valve tricuspide et de la valve mitrale (losange), et une fuite mitrale par le cleft du feuillet antérieur (flèche verticale). Ceci résulte d'une non-fusion du septum interauriculaire, du septum interventriculaire et des deux bourgeons valvulaires auriculo-ventriculaires centraux (endocardial cushion defect). Embryologiquement, les deux valves sont constituées à partir de 5 bourgeons; deux seront les feuillets postérieur et antérieur de la tricuspide (A et B), un sera la feuillet postérieur de la mitrale (C) et les deux bourgeons transverses (D et E) fusionneront pour donner le feuillet septal de la tricuspide et le feuillet antérieur de la mitrale. Les deux feuillets transverses ont des cordages insérés de chaque côté du septum.
A l'échocardiographie 2D, les deux valves tricuspide et mitrale sont typiquement situées sur le même plan et insérées au même niveau sur le septum dans le long axe du coeur (vue 4-cavités 0°) (Vidéo et Figure 27.157) [4]. A cause de ce déplacement de l'anneau mitral, l’aorte est positionnée plus antérieurement que normalement; la CCVG est allongée et déformée, ce qui la rend sujette à des sténoses. L'insertion ventriculaire des cordages du feuillet mitral antérieur et du feuillet septal de la tricuspide doivent être soigneusement inspectés à cause du risque d'insertion dans le ventricule controlatéral à travers la CIV (straddling).
Vidéo: vue 4-cavités d'un canal AV caractéristique: présence d'une CIA de type ostium primum, d'une CIV de la chambre d'admission et d'une insertion septale des deux valves atrio-ventriculaires sur le même plan.

Figure 27.157 : Vues 4-cavités de canal AV. A : au-dessus d'une large CIV de la chambre d'admission, les deux valves mitrale et tricuspide sont insérées au même niveau du septum. B : présence d’une CIA de type ostium primum (flèche verte) et d’une CIV contiguë (flèche jaune); les deux valves AV sont sur le même plan. C : autre configuration anatomique de la même pathologie. D : CIA ostium primum isolée dans un canal AV partiel.
Les différents orifices communiquent entre eux, et le shunt peut prendre de nombreuses directions: VG→VD, VG→OD, OG→OD, OG→VD. Les fentes sont associées à une insuffisance mitrale (VG→OG) et à une insuffisance tricuspidienne (VD→OD) (Figure 27.158). Dans certains cas, le canal AV est partiel, et ne comprend qu’une CIA avec ou sans cleft, ou une CIV sans lésion auriculaire. Le canal AV est associé à la trisomie 21 dans 35% des cas [9]. Il peut aussi être lié à une tétralogie de Fallot, à une sténose pulmonaire, à un retour veineux pulmonaire anormal ou au ventricule droit à double issue.

Figure 27.158 : Flux couleur dans un canal AV. A : double régurgitation mitrale par la commissure anatomique (IM, flèche jaune) et par une fente (cleft) de canal AV (flèche verte). B : fuite tricuspidienne (IT) et fuite mitrale par une fente (flèche). Les fuites issues des fentes se reconnaissent à leur position accolée au septum interauriculaire. C : passage composite du flux entre l'OG, l'OD et le VD; à noter la dilatation du VD. D : passage accéléré (aliasing) entre les 4 cavités en diastole.
Le flux couleur est complexe et peut prendre différentes configurations selon les gradients de pression en systole et en diastole (Vidéo):
- Shunt entre l’OG et l’OD ou entre le VG et le VD;
- Shunt oblique entre le VG et l’OD (défaut de Gerbode);
- Régurgitation tricuspidienne et/ou mitrale à travers la fente (Vidéo et Figure 27.158); ces fuites sont localisées à coté du septum; cette position juxta-septale les différencie d’une fuite d’IT ou d’IM à la commissure de la valve.
Vidéo: flux composite du shunt gauche - droit entre l'OG et l'OD et entre le VG et le VD.
Vidéo: flux de régurgitation mitrale à travers la fente (cleft) située à la racine du feuillet antérieur, jouxtant le septum. Il existe également une IM à la commissure physiologique.
Selon les variantes anatomiques, on rencontre une surcharge de volume et/ou de pression qui prédomine sur le VG ou le VD.
- Dans le canal AV partiel où il n’y a qu'une CIA et pas de CIV, la surcharge de volume prédomine sur le VD; l’OD et l’AP sont dilatées;
- Une IT ou une IM majeure dilatent l’OD et le VD ou l’OG et le VG, respectivement;
- Une CIV dominante provoque une dilatation et une hypertrohie du VG et de l’AP;
- Lorsqu’elle est large, la CIV provoque une hypertension pulmonaire assez tôt dans l'évolution de la maladie, et secondairement une hypertrophie du VD par surcharge de pression.
La correction chirurgicale du canal AV consiste à fermer la CIA et la CIV avec des patches et à corriger les fuites tricuspidienne et mitrale. Elle a lieu dans les 6 premiers mois de vie pour éviter l’hypertrophie ventriculaire et l’hypertension pulmonaire [12,14]. L’examen ETO après la CEC doit rechercher certains points particuliers.
- Fuite résiduelle au niveau de la CIA et/ou de la CIV;
- IT et/ou IM résiduelle après plastie des fentes, éventuelle sténose;
- Nouvelle IT et/ou IM par la commissure physiologique due à une rétraction du feuillet septal de la tricuspide ou antérieur de la mitrale par la correction chirurgicale;
- Fuite aortique nouvelle à cause de la traction opérée par la correction du cleft mitral;
- Obstruction dynamique de la CCVG.
Cet examen post-CEC est particulièrement important pour pouvoir corriger des défauts résiduels dans le même temps opératoire. En effet, le taux de reprise chez l'adulte après une correction réalisée dans l'enfance est très élevé (11-32%) [7]. Les réopérations après canal AV sont si fréquentes qu'elles représentent jusqu'à 10% de la chirurgie cardiaque chez les congénitaux adultes [3]. Le matériel prosthétique utilisé pour les patches crée une importante zone d’ombre distale qui masque l’OD et le VD en vues rétrocardiaques. Des vues transgastriques en court-axe et en long-axe sont alors nécessaires pour identifier le flux couleur turbulent dans les cavités droites. La présence d’une zone d'accélération concentrique (PISA) sur la face gauche du septum signe une CIV résiduelle importante. Les causes les plus fréquentes de reprise sont l’insuffisance mitrale ou tricuspidienne, le shunt G-D résiduel, l’obstruction de la CCVG (gradient moyen > 50 mmHg) ou la dysfonction du VG [8,14].
| Canal AV |
|
Défaut de septation centrale du coeur
Association partielle ou complète de: CIA (ostium primum) + CIV (chambre d’admission) + fente
mitrale + fente tricuspide + déformation de la CCVG
Insertion des feuillets septal tricuspidien et antérieur mitral au même niveau sur le septum
Shunt G→D complexe (CIA + CIV + passages obliques)
Surcharge VD: volume (CIA) et/ou pression si hypertension pulmonaire (CIV)
Surcharge VG: volume (selon l'importance de la CIV)
Risque de sténose dynamique de la CCVG
|
Anomalie d’Ebstein
L'anomalie d'Ebstein est caractérisée par un déplacement apical de l’implantation des feuillets septal et postérieur de la valve tricuspide de plus de 15 mm (> 0.8 cm/m2) à l'intérieur du VD (Vidéo) (Figure 27.159 et 27.160) [1]. Ces deux feuillets présentent une mobilité réduite à cause du raccourcissement et de la fibrose progressive des cordages, alors que le feuillet antérieur est redondant et reste en général souple, mobile et normalement positionné [11]. La cavité ventriculaire droite est petite; la chambre d'admission du VD se retrouve faire partie de l'oreillette droite; elle est dite "atrialisée". L'OD est très dilatée. Une CIA est présente dans > 50% des cas [13]. Le VD est très restrictif malgré son aspect arrondi; il est fonctionnellement insuffisant (Vidéos).
Vidéo: maladie d'Ebstein; les feuillets septal et postérieur de la valve tricuspide sont bas-insérés, alors que le feuillet antérieur est en position normale.
Vidéo: maladie d'Ebstein; les feuillets septal et postérieur de la valve tricuspide sont bas-insérés, alors que le feuillet antérieur est en position normale.
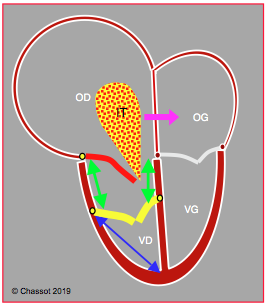
Figure 27.159 : Schéma de la maladie d’Ebstein. Les feuillets septal et postérieur de la tricuspide (en jaune) sont bas insérés (> 1.5 cm en dessous de l’insertion de la valve mitrale), alors que le feuillet antérieur (en rouge) est en position normale ; la chambre d’admission du VD se retrouve dans l’OD (flèches vertes). L’OD est très dilatée, le VD est restrictif. L’insuffisance tricuspidienne (IT) est en général importante. S’il existe un FOP ou une CIA, le shunt est fréquemment D-G et cyanogène (flèche violette) parce que l’OD est en surpression. Le rapport entre la longueur de l’atrialisation du VD (flèches vertes) et celle de la cavité fonctionnelle du VD (flèche bleue) doit être < 0.4 pour permettre une plastie valvulaire ; celle-ci utilise le feuillet antérieur soit comme seul élément de fermeture de la valve (reconstruction monovalve), soit en combinaison avec un des deux autres feuillets lorsqu’un seul est bas inséré (reconstruction bicuspide).

Figure 27.160 : Maladie d’Ebstein (vues 4-cavités basses). A : bas-insertion du feuillet septal (flèche verte) et du feuillet postérieur (flèche bleue) de la valve tricuspide. La double flèche jaune indique la longueur de l’atrialisation du VD. B: bas-insertion du feuillet postérieur (FP, flèche bleue) et du feuillet septal (FS, flèche verte); insertion normale du feuillet antérieur (FA, flèche jaune). Le trait pointillé jaune marque la limite anatomique entre l'OD et le VD; le traitillé blanc indique la limite fonctionnelle; la surface située entre les deux traits représente la zone atrialisée du VD. La cavité réelle du VD est très réduite.
Vidéo: défaillance droite dans le cadre d'une maladie d'Ebstrein; on voit bien l'ampleur du feuillet antérieur.
Vidéo: défaillance droite dans le cadre d'une maladie d'Ebstrein en vue court-axe transgastrique.
La valve tricuspide peut être insuffisante, sténotique, ou les deux (Vidéos). L’importance de l’insuffisance tricuspidienne (IT) est facilement sous-estimée à cause de l’immensité de l’OD et de la basse vélocité du flux lié à la grande taille de l’orifice de régurgitation et/ou à la dysfonction droite, elle-même souvent sous-estimée à cause du remodelage ventriculaire (Figure 27.161). L'origine du jet de l'IT est située typiquement très bas dans le VD [10]. Il n'y a que peu de corrélation entre la morphologie à l'échocardiographie et le retentissement fonctionnel de la maladie [13].
Vidéo: insuffisance tricuspidienne massive dans un cas de maladie d'Ebstein.
Vidéo: vue admission-chasse du VD montrant une insuffisance tricuspidienne dans une anomalie d'Ebstein. Le VD est plus court que normalement.
Vidéo: insuffisance tricuspidienne massive dans un cas de maladie d'Ebstein.
Vidéo: vue admission-chasse du VD montrant une insuffisance tricuspidienne dans une anomalie d'Ebstein. Le VD est plus court que normalement.

Figure 27.161: Vue échocardiographique transoesophagienne d'une insuffisance tricuspidienne massive dans un cas d’anomalie d'Ebstein. La flèche jaune indique la basse insertion du feuillet septal.
L’opération consiste en une atrioplastie de réduction et en une plastie de la valve tricuspide avec transformation en une monovalve dont l’occlusion n’est assurée que par le feuillet antérieur, ou en une bicuspidie lorsqu’un seul feuillet est bas-implanté. Ceci n’est possible que si le feuillet antérieur est assez grand et assez mobile et si la cavité fonctionnelle du VD est au moins le tiers de sa cavité totale. Cette plastie transforme le tissu valvulaire en une forme de cône (cone procedure) [6]. Un remplacement de la valve ne peut pas toujours être évité. Si elle est présente, la CIA est fermée par un patch. Si le VD est hypoplasique, une anasotomose cavopulmonaire supplémentaire (implantation de la VCS dans l'AP droite, ou shunt de Glenn) est parfois nécessaire pour assurer un débit pulmonaire satisfaisant [5]. L’examen ETO s’attache à décrire les éléments qui modifient la stratégie chirurgicale (vues 4-cavités 0°, admission-chasse du VD 60°, admission du VD transgastrique 100°).
- Mobilité des feuillets tricuspidiens, particulièrement du feuillet antérieur car celui-ci devient le principal élément de la valve après la correction chirurgicale (valve monocuspide);
- Quantification de la fuite ou de la sténose tricuspidienne;
- Taille de l’OD (dilatation si diamètre > 6 cm);
- Taille et fonction du VD; un rapport entre la longueur atrialisée et celle de la cavité du VD > 0.4 est un prédicteur de mauvaise fonction ventriculaire;
- Présence de shunt (CIA, FOP);
- Les éléments favorables à la reconstruction sont un feuillet antérieur ample, long et mobile, une absence d’insertions musculaires directes des feuillets, une fonction VD conservée et un seul jet de régurgitation central.
Après la correction chirurgicale, on évalue la fonction droite, la présence d’une IT résiduelle et le gradient antérograde à travers la tricuspide. Le gradient maximal acceptable est 5 mmHg; un ΔPmax > 5 mmHg signe une restriction, mais un ΔPmoyen > 5 mmHg signe une sténose [6].
Lésions congénitales de la valve mitrale
La sténose congénitale de la valve mitrale est une hypoplasie des feuillets et de l’appareil sous-valvulaire qui conduit à une valve restrictive et épaissie dont l’orifice fonctionnel est petit et souvent décentré. Dans la valve mitrale en parachute, tous les cordages s’insèrent sur le même pilier unique et central; la valve est en général sténotique, avec ou sans régurgitation associée. On rencontre cette anomalie dans le syndrome de Shone (valve mitrale en parachute, sténose sous-aortique, hypoplasie aortique, coarctation de l'aorte). On peut rencontrer des fentes mitrales isolées donnant une fuite située en-dehors de la commissure.
Après réparation, il est important d’exclure toute fuite majeure, mais la décision de reprise chirurgicale doit se fonder sur le mécanisme de la régurgitation, sur la faisabilité de la plastie et sur le status hémodynamique du patient; on est en général plus tolérant avec les fuites résiduelles sur les valves malformées que lors des plasties sur des valves anatomiquement normales [2].
| Anomalies des valves AV |
|
Anomalie d'Ebstein: implantation apicale des feuillets postérieur et septal de la tricuspide avec rétrécissement de la cavité du VD, atrialisation de sa chambre d’admission, dilatation de l’OD et insuffisance tricuspidienne.
Valve mitrale: sténose congénitale, valve en parachute (pilier unique).
|
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- BAUMGARTNER H, BONHOEFFER B, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BENGUR AR, LI JS, HERLONG JR, et al. Intraoperative transesophageal echocardiography in congenital heart disease. Seminars Thorac Cardiovasc Surg 1998; 10:255-64
- BERGIN ML, WASHES CA, TAJIK AJ, et al. Partial atrioventricular canal defect: long term follow-up after initial repair in patients ≥ 40 years old. J Am Coll Cardiol 1995; 25:1189-94
- BETTEX D, CHASSOT PG. Transesophageal echocardiography in congenital heart disease. In: BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1186-1212
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital heart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- DEARANI JA, SAID SM, O'LEARY PW, et al. Anatomic repair of Ebstein's malformation: lessons learned with cone reconstruction. Ann Thorac Surg 2013; 95:220-6
- HOOHENKERK GJ, BRUGGEMANS EF, KOOLBERGEN DR, et al. Long-term results of reoperation for left atrio-ventricular valve regurgitation after correction of atrio-ventricular septal defects. Ann Thor Surg 2012; 93:849-55
- McGRATH LB, GONZALEZ-LAVIN L. Actuarial survival, freedom from reoperation, and other events after repair of atrioventricular septal defects. J Thorac Cardiovasc Surg 1987 ; 94: 582-590
- PICCOLI GP. Morphology and classification of complete atrioventricular defects. Brit Heart J 1979; 42:633-9
- RUSSEL IA, ROUINE-RAPP K, STRATMANN G, MILLER-HANCE WC. Congenital heart disease in adult: A review with Internet-accessible transesophageal echocardiographic images. Anesth Analg 2006; 102:694-723
- SHIINA A, SEWARD JB, EDWARDS WD, et al. Two-dimensional echocardiographic spectrum of Ebstein’s anomaly: detailed anatomic assessment. J Am Coll Cardiol 1984; 3:356-370
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- WARNES CA. Adult congenital heart disease. Importance of the right ventricle. J Am Coll Cardiol 2009; 54:1303-10
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
