La valve pulmonaire est fine, peu échogène et très antérieure, ce qui rend sa visualisation difficile en ETO, d'autant plus qu’elle est située devant la valve aortique qui lui fait écran. Elle ne possède pas d'anneau fibreux, mais est insérée directement à la jonction entre la chambre de chasse droite (CCVD), qui est cylindrique et entièrement musculaire, et la racine de l'artère pulmonaire. Son diamètre est un peu plus grand que celui de la valve aortique: 24 mm chez la femme et 26 mm chez l'homme en moyenne [3]. Sa surface normale est 2 cm2/m2. Elle est située au même niveau que la valve aortique, mais dans un plan perpendiculaire : elle apparaît en court-axe dans le plan long-axe de la valve aortique et vive-versa. Ses trois feuillets sont antérieur, droit et gauche; ils sont en miroir de ceux de la valve aortique (Figure 26.138) [14].
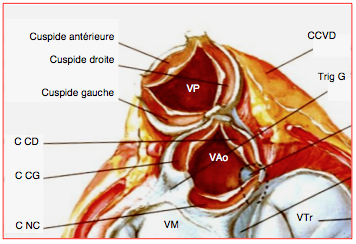
Figure 25.138 : Situation anatomique de la valve pulmonaire (VP) dans une section horizontale des gros vaisseaux et des oreillettes. Elle est située en avant de la valve aortique (VAo). Ses cuspides sont en miroir des cuspides aortiques: cuspide droite face à la cuspide coronaire droite (CD), cuspide gauche face à la cuspide coronaire gauche (CG), et cuspide antérieure en symétrie avec la cuspide non-coronaire (NC) qui est postérieure. Trig G: trigone fibreux gauche. CCVD: chambre de chasse du VD.
Echocardiographie
Les plans d’examen de la valve pulmonaire sont multiples mais peu codifiés et réalisables de manière inconstante à l'ETO (voir Figures 26.128 et 26.129) [5].

Figure 25.138 : Situation anatomique de la valve pulmonaire (VP) dans une section horizontale des gros vaisseaux et des oreillettes. Elle est située en avant de la valve aortique (VAo). Ses cuspides sont en miroir des cuspides aortiques: cuspide droite face à la cuspide coronaire droite (CD), cuspide gauche face à la cuspide coronaire gauche (CG), et cuspide antérieure en symétrie avec la cuspide non-coronaire (NC) qui est postérieure. Trig G: trigone fibreux gauche. CCVD: chambre de chasse du VD.
Echocardiographie
Les plans d’examen de la valve pulmonaire sont multiples mais peu codifiés et réalisables de manière inconstante à l'ETO (voir Figures 26.128 et 26.129) [5].
- Vue court-axe de l’aorte ascendante (0°). Valve pulmonaire en long axe, avec l’origine du tronc de l’artère pulmonaire ; vue du feuillet antérieur à droite de l'écran et du feuillet gauche ou droit proximalement à l'aorte (selon profondeur de la sonde). Bon accès à la mesure du flux pulmonaire à condition de placer l’axe du Doppler bien au milieu de l’AP (Figure 26.128A).
- Vue admission – chasse du VD (45-60°). Vue long axe de la CCVD (diamètre 25-30 mm), de la valve pulmonaire et de la racine de l’AP ; feuillet antérieur (le plus éloigné) et gauche (ou droit selon la rotation de la sonde). La hauteur de coaptation des cuspides est de 5-7 mm (Figure 26.128B).
- Vue long axe de la valve aortique (120-160°). Seule vue court-axe de la valve pulmonaire avec ses 3 cuspides (Figure 26.128C). Le taux de succès pour cette vue n'est que de 60% [12].
- Vue court-axe de la crosse aortique (90°). La valve pulmonaire apparaît en bas à gauche de l’écran. Cette vue se prête bien à l'analyse du flux Doppler à travers la valve (Figure 26.129).
- Vue transgastrique admission-chasse du VD (120°). Vue de la CCVD, de la valve pulmonaire et de la racine de l’AP en bas de l'écran, vers la gauche; bon axe Doppler pour mesurer le flux dans la CCVD (Doppler pulsé) et la valve pulmonaire (Doppler continu) (Figure 26.129B).
- Vue transgastrique basale du VD (10-30°). Vue de la CCVD analogue à la précédente, mais souvent mieux alignée; la valve pulmonaire est en bas de l'écran (Figure 26.129C).
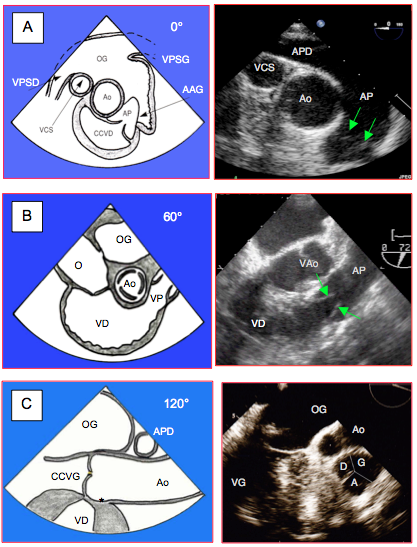
Figure 26.128 : Vues ETO mi-œsophage de la valve pulmonaire. A : vue basale court axe de l’aorte ascendante (0°), avec la valve pulmonaire et la racine de l’artère pulmonaire (AP). VPSD : veine pulmonaire supérieure droite. VPSG : veine pulmonaire supérieure gauche. AAG : appendice auriculaire gauche. APD: artère pulmonaire droite. VCS : veine cave supérieure. Les flèches vertes signalent les feuillets de la valve pulmonaire. B : vue admission-chasse du VD (60°), avec la chambre de chasse du VD, la valve pulmonaire (VP) et la racine de l’AP. La hauteur de coaptation est de 5-7 mm (en cartouche). C : Vue long-axe de la valve aortique (120°) à partir de laquelle on peut obtenir une vue court-axe de la valve pulmonaire. A: cuspide antérieure. D: cuspide droite. G: cuspide gauche.
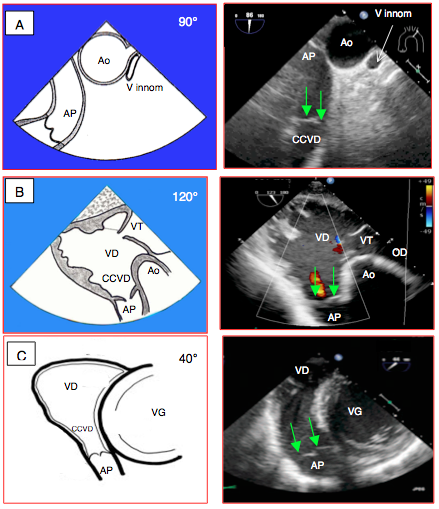
Figure 26.129 : Vues ETO de la valve pulmonaire. A: vue court-axe de la crosse aortique (0°), avec l’artère et la valve pulmonaires. V Innom : veine innominnée. B: vue transgastrique admission-chasse du VD (120°), avec la chambre de chasse du VD (CCVD), la valve pulmonaire et l’AP. C: vue transgastrique basale du VD (10-30°) avec une vue analogue sur la CCVD. Les flèches vertes indiquent l'emplacement des feuillets pulmonaires. Dans ces trois vues, le faisceau Doppler est bien dans l'axe du flux de la CCVD et de la valve pulmonaire.
Le tronc de l'artère pulmonaire mesure environ 5 cm de long et 28-33 mm de diamètre. L'artère pulmonaire droite est plus large que la gauche. De cette dernière, on n'aperçoit que le départ à l'ETO à cause de l'interposition de la bronche-souche gauche. Chez l’adulte, les pathologies graves situées au niveau de la chambre de chasse droite (CCVD) et de la valve pulmonaire sont rares, alors qu’elles sont fréquentes parmi les cardiopathies congénitales.
La voie d'éjection droite est très pulsatile: son diamètre se modifie considérablement entre la systole et la diastole. Lors de mesures comme celle de l'équation de continuité, la plus grande rigueur est requise pour identifier la dimension correspondant au même moment du cycle cardiaque que la mesure du flux ou du volume transité. Les mesures concernant une sténose sont faites en systole, celles concernant une insuffisance en diastole. En systole, la lumière de la CCVD se rétécit alors que celle de l'artère pulmonaire se dilate; c'est l'inverse en diastole.
Insuffisance pulmonaire
La prévalence d’une petite insuffisance pulmonaire (IP) est de 30-75% dans la population générale selon l'âge [6,15]. Une IP significative est en général secondaire à une hypertension pulmonaire avec dilatation de l’anneau, de l’artère pulmonaire et de la CCVD. Une IP sévère est liée à une anomalie structurelle de la valve, d’origine congénitale (monocuspidie, bicuspidie, Marfan, prolapsus) ou acquise (carcinoïde, endocardite, RAA, traumatisme); elle est fréquente après une valvulotomie pour sténose comme dans la correction de la tétralogie de Fallot (TdF), ou après correction de truncus arteriosus. Même majeure, une IP reste longtemps asymptomatique, mais elle entraine une dilatation du VD par surcharge de volume et une dysfonction droite. Le volume de la régurgitation est proportionnel à la surface de l'orifice béant en diastole, mais il est aussi influencé par la pression pulmonaire, la compliance du VD et la durée de l'insuffisance pendant la diastole [10].
L’image ETO est caractéristique, bien que les critères de sévérité pour la valve pulmonaire soient moins bien validés que ceux des autres valves (Figure 26.139) (Tableau 26.11) [7,10,14].
- Aspect bidimensionnel: dilatation annulaire, rétraction ou prolapsus de cuspide(s), orifice diastolique béant après valvulotomie ou patch d'élargissement (correction de sténose congénitale ou de TdF).
- Flux couleur: jet diastolique dans la chambre de chasse droite (limite de Nyquist 50-60 cm/s). Mesures possibles: diamètre du jet par rapport à celui de la CCVD, vena contracta; flux rétrograde dans l'AP (Vmax > 1.2 m/s); ce flux doit être visible en diastole jusque dans l'AP droite pour que l'IP soit qualifiée de sévère.
- IP mineure : petit jet coloré fin et bref (mésodiastolique), issu d’une commissure ou de la coaptation centrale de la valve, dirigé dans l’axe de la CCVD, très variable avec la respiration; étendue du jet < 1.0 cm; tracé Doppler spectral faible (Vidéo).
- IP modérée : diamètre de la vena contracta 2-5 mm ; étendue du jet > 2.0 cm (tributaire de la PAP et de la Ptd VD) ; flux holodiastolique de Vmax > 1.5 m/s. La largeur du jet représente 35-50% de celle de la CCVD. Sa densité au Doppler spectral est proportionnelle au nombre d'hématies, donc à l'importance de l'IP.
- IP sévère : diamètre de la vena contracta > 0.5 cm (indice le plus robuste), dilatation du VD, de la CCVD et de l’AP. La rapide égalisation des pressions entre l’AP et le VD fait que le jet ne dure pas toute la diastole. La Vmax est souvent basse (flux couleur sans turbulences) parce que l’orifice est large. Le reflux diastolique dans l’AP est massif au flux couleur et au Doppler spectral (Vidéos). La largeur du jet représente > 60% de celle de la CCVD. Le VD est dilaté (Vtd > 150 mL/m2, Vts > 70 mL/m2) et les arythmies fréquentes. L’IP sévère est une indication opératoire au remplacement de la valve [1].
Vidéo: vue transgastrique admission-chasse du VD 120° présentant une petite insuffisance pulmonaire physiologique.
Vidéo: flux dans l'artère pulmonaire lors d'une insuffisance pulmonaire massive; le flux antérograde systolique est laminaire (Vmax 0.5 m/s), alors que le flux rétrograde diastolique est turbulent (Vmax 1.5 m/s).
Vidéo: vue long-axe 60° de la valve pulmonaire dans un cas de syndrome carcinoïdien. Les cuspides ne coaptent pas en systole, le reflux diastolique est massif dans la chambre de chasse du VD, qui est dilatée.
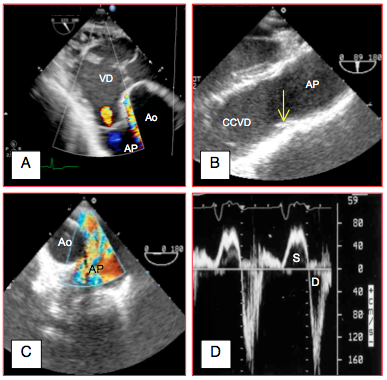
Figure 26.139 : Flux de régurgitation en cas d’insuffisance pulmonaire (IP). A : IP mineure dans la CCVD en vue chambre de chasse du VD transgastrique 120°. B : quasi-disparition (flèche jaune) des cuspides pulmonaires 15 ans après un patch d'élargissement pour tétralogie de Fallot. C : reflux couleur diastolique tourbillonnant dans l’AP proximale en cas d’IP sévère (vue oesophagienne haute en court axe de l’aorte ascendante 0°). D: Doppler spectral dans de le tronc de l'AP du même cas; le reflux diastolique est massif (Vmax 1.6 m/s). S : composante systolique. D : reflux diastolique. Pour confirmer la sévérité de l'IP, le même reflux doit être présent dans la branche droite de l'AP et non seulement dans sa partie proximale.
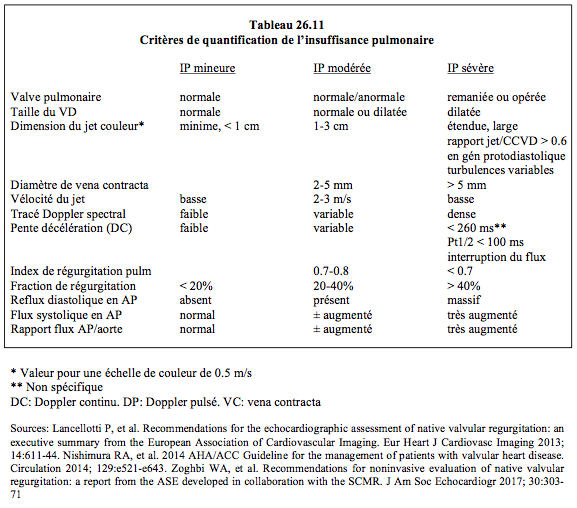
Le Doppler spectral du flux d'IP, lorsqu'elle est majeure, autorise certains calculs qui contribuent à l'évaluation hémodynamique (Figure 26.140).
- PAPmoy: la Vmax protodiastolique du flux d'IP permet de calculer la PAP en protodiastole (pd), qui est équivalente à la PAPmoy. L'équation de Bernoulli calcule le gradient de pression entre l'AP et le VD en début de diastole, en admettant que la pression du VD est équivalente à celle de l'OD: PAPm = 4 (Vmax IPpd)2 + POD.
- PAPdiast: la Vmax en télédiastole (td) du flux d'IP est utillisée pour calculer la PAPdiast par l'équation de Bernoulli: PAPd = 4 (Vmax IPtd)2 + POD.
- Le rapport entre la Vmax de l'IP et l'intégrale des vélocités dans la CCVD permet d'évaluer les RAP (U Wood).
- Temps de demi-pression calculé par la pente de décélération du flux d'IP: un Pt1/2 de 100 ms correspond à une IP sévère (durée de décélération < 250 ms) [13].
- L’indice de régurgitation pulmonaire (IRP) est le rapport entre la durée de l’insuffisance pulmonaire (IP) et la durée de la diastole ; lorsque l’IP est sévère, les pressions s’égalisent rapidement entre l’AP et le VD, la pente de décélération du flux de l’IP est raide et l’insuffisance cesse en cours de diastole. Lorsque l’IP est modérée, la pente de décélération est plus faible et l’IP dure toute la diastole. Un IRP < 0.75 signe une fraction de régurgitation > 35% (Figure 26.141) [8].
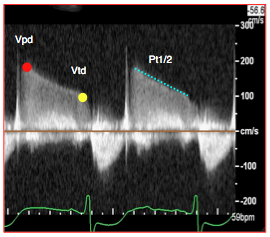
Figure 26.140 : Flux Doppler continu d'une IP modérée à sévère. Le flux est enregistré à travers la chambre de chasse droite en vue transgastrique 0°. La Vmax protodiastolique (point rouge) permet de calculer la PAPmoy; la Vmax télédiastolique (point jaune) permet de calculer la PAPdiast. La pente de décélération détermine le Pt1/2.
Figure 26.141 : Indice de régurgitation pulmonaire (IRP) ou rapport entre la durée de l’insuffisance pulmonaire et la durée de la diastole. A: schéma; durée de l'IP (flèche bleue) et durée de la diastole (flèche rouge). Lorsque l’IP est sévère, les pressions s’égalisent rapidement entre l’AP et le VD, et la pente de décélération du flux de l’IP est plus raide (pointillé bleu). B: exemple d'un cas d'IP sévère. L'IRP est ici < 0.7 et le Pt1/2 < 100 ms (pointillé bleu).
Le calcul de la fraction d'éjection du VD n'est pas fiable en écho bidimensionnelle mais assez performant en écho tridimensionnelle. Toutefois, même avec la technologie 3D, l'échocardiographie tend à sous-estimer le volume du VD; l'IRM est la seule technique qui permette une mesure exacte du volume droit. D'autres mesures que la FE sont utiles pour évaluer la fonction du VD: excursion systolique de l'anneau tricuspidien (TAPSE), vélocité de déplacement de l'anneau en systole (S' au Doppler tissulaire), déformation longitudinale globale en systole (strain), vélocité de la contraction isovolumétrique (voir Chapitre 25, Indices fonctionnels du VD) [10].
L'indication opératoire au remplacement valvulaire par une prothèse (en CEC ou par voie endovasculaire) est dictée principalement par la dilatation du VD; il n'y a néanmoins pas de consensus clair sur des citères précis [10]. Ceux qui sont habituellement retenus sont les suivants (modulables selon la situation clinique).
- Volune télédiastolique du VD ≥ 150 mL/m2 (mesure en écho 3D ou en IRM);
- Volume télésystolique ≥ 70 mL/m2 (mesure en écho 3D ou en IRM);
- FE du VD < 40%;
- Fraction de régurgitation > 35%;
- Symptomes cliniques: insuffisance congestive du VD, arythmies ventriculaires, dyspnée.
Le diamètre de la CCVD distale est une mesure essentielle, car les endoprothèses actuelles (Melody™, Sapien™) ne peuvent pas être implantées si la dilatation est importante.
Sténose pulmonaire
La sténose pulmonaire (S < 2 cm2/m2), rare chez l’adulte, est en général congénitale (fusion commissurale, monocuspidie, bicuspidie) ou secondaire à un carcinoïde. Alors que la Vmax normale à travers la valve est 0.5 – 1.0 m/s, la sténose se caractérise par des flux accélérés en protosystole et une image de turbulence au Doppler couleur [2].
Sténose pulmonaire
La sténose pulmonaire (S < 2 cm2/m2), rare chez l’adulte, est en général congénitale (fusion commissurale, monocuspidie, bicuspidie) ou secondaire à un carcinoïde. Alors que la Vmax normale à travers la valve est 0.5 – 1.0 m/s, la sténose se caractérise par des flux accélérés en protosystole et une image de turbulence au Doppler couleur [2].
- Sténose mineure : Vmax < 2 m/s ; ΔP max < 20 mmHg;
- Sténose modérée : Vmax 2.5 – 3.5 m/s ; ΔP max 25-50 mmHg;
- Sténose sévère : Vmax > 4 m/s ; ΔP max > 64 mmHg ; S ≤ 0.5 cm2 (équation de continuité).
Rétrécies, épaissies et peu mobiles, les cuspides pulmonaires offrent en long-axe un aspect en dôme au cours de la systole. L'ETO 2D ne permet pas de tracer la planimétrie de l'ouverture systolique. Le VD est sévèrement hypertrophié, parfois dilaté en cas de défaillance (Figure 26.142) (Vidéo). Le tronc de l’AP est dilaté au-delà de la sténose. Dans une homogreffe ou une hétérogreffe pulmonaire, on tolère un ΔP maximal jusqu’à 20 mmHg lorsque le VD est normal (opération de Ross) et de 20-40 mmHg en cas d’HVD (selon le gradient préopératoire) (Vidéo). Un ΔPmax ≥ 50 mmHg est une indication opératoire au remplacement valvulaire [2].
Vidéo: hypertrophie concentrique du VD dans un cas de sténose pulmonaire.
Vidéo: hétérogreffe de type Contegra en remplacement de la valve pulmonaire (vue court-axe de la crosse aortique 100°).
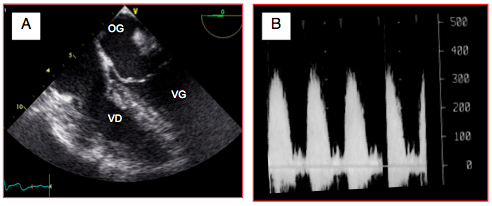
Figure 26.142 : Sténose pulmonaire. A : hypertrophie concentrique majeure du VD. B : flux Doppler spectral; la Vmax est de 3,75 m/s et le gradient de pression de 55 mmHg, ce qui représente une sténose modérée-à-sévère.
Sténose dynamique de la CCVD
L'hypertrophie du VD secondaire à une sténose pulmonaire congénitale donne lieu à un épaississement considérable de la paroi ventriculaire, y compris dans la chambre de chasse. Dans la CCVD, ce phénomène engendre un rétrécissement dynamique majeur en systole, la lumière devenant minuscule pendant l'éjection (Vidéo et Figure 26.143). Cette sténose sous-valvulaire musculaire se différencie d'une sténose organique de la valve de plusieurs manières.
Vidéo: sténose dynamique sous-pulmonaire dans une tétralogie de Fallot (vue long-axe de la CCVD 80°); le flux couleur est rétréci à un mince filet. La valve et l'artère pulmonaires sont hypoplasiques.
Vidéo: hypertrophie concentrique du VD dans un cas de sténose pulmonaire.
Vidéo: hétérogreffe de type Contegra en remplacement de la valve pulmonaire (vue court-axe de la crosse aortique 100°).

Figure 26.142 : Sténose pulmonaire. A : hypertrophie concentrique majeure du VD. B : flux Doppler spectral; la Vmax est de 3,75 m/s et le gradient de pression de 55 mmHg, ce qui représente une sténose modérée-à-sévère.
Sténose dynamique de la CCVD
L'hypertrophie du VD secondaire à une sténose pulmonaire congénitale donne lieu à un épaississement considérable de la paroi ventriculaire, y compris dans la chambre de chasse. Dans la CCVD, ce phénomène engendre un rétrécissement dynamique majeur en systole, la lumière devenant minuscule pendant l'éjection (Vidéo et Figure 26.143). Cette sténose sous-valvulaire musculaire se différencie d'une sténose organique de la valve de plusieurs manières.
Vidéo: sténose dynamique sous-pulmonaire dans une tétralogie de Fallot (vue long-axe de la CCVD 80°); le flux couleur est rétréci à un mince filet. La valve et l'artère pulmonaires sont hypoplasiques.
- Imagerie 2D: épaississement de la paroi de la CCVD, rétrécissement de la lumière en systole;
- Flux couleur: passage étroit et flux accéléré en amont de la valve;
- Doppler spectral: pic de vélocité en télésystole (dans la sténose valvulaire, le pic est proto- ou mésosystolique).
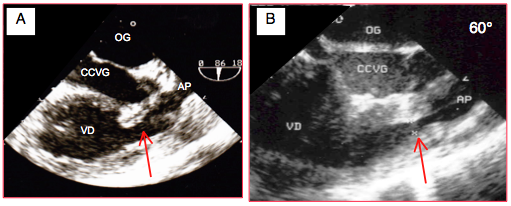
Figure 26.143 : Sténose pulmonaire dynamique. Deux exemples de sténose pulmonaire complexe lors de tétralogie de Fallot, en vue mi-oesophage 90° par rotation horaire de la sonde à partir d’une vue 2-cavités du VG. La chambre de chasse droite est étroite et hypertrophiée, la valve pulmonaire sténosée est mal discernable dans le rétrécissement proximale de l’artère pulmonaire. Le VD est hypertrophié. En B, le diamètre de la CCVD en systole est de 0.43 cm (flèche rouge).
Bien qu'hypertrophié (épaisseur de la paroi libre > 6 mm), le VD ne jouit pas forcément d'une fonction normale. La fraction d'éjection est un repère peu fiable vu la forme complexe et le remaniement structurel du ventricule. D'autres indices sont plus pertinents, comme l'indice de Tei, la vélocité S' du déplacement de l'anneau tricuspidien, la déformation longitudinale globale (strain) ou l'accélération de la phase isovolumétrique (voir Chapitre 25, Fonction ventriculaire droite, Indices fonctionnels) [9,11]. La FE peut être évaluée en écho 3D.
La chambre de chasse du VD est plus richement dotée en récepteurs béta que le corps du ventricule. En cas de stimulation catécholaminergique, sa réponse inotrope est plus importante que celles de la paroi libre et de la chambre d’admission. Elle peut être à l’origine d’une obstruction dynamique (effet CMO droit), que l’on a décrite dans 1-4% des cas d’instabilité hémodynamique accompagnée d’hypovolémie et de stimulation catécholaminergique [4]. En vue long axe de la CCVD (mi-œsophage 60-90°), on voit un rétrécissement systolique important. Lorsqu’il est dans l’axe de la CCVD (vue transgastrique long axe du VD 30° ou 120°), le Doppler enregistre une Vmax de 2-2.5 m/s dont le pic est télésystolique (aspect en dague) et un gradient de > 20 mmHg. Cette obstruction dynamique est fréquente après remplacement de la valve pulmonaire pour sténose si le VD est très hypertrophié.
| Pathologies de la valve pulmonaire |
| Valve fine, antérieure et peu échogène - Vue court-axe aorte ascendante 0° - Vue admission-chasse VD 60° - Vue long-axe aorte ascendante 120-140° (court axe de la V Pulm) - Vue CCVD transgastrique 30° ou 120° Insuffisance pulmonaire - IP mineure chez 70% des sujets sains - IP modérée : holosystolique, jet > 2.0 cm, Vmax 1.5 – 2.5 m/s, vena contracta 2.5 mm - IP sévère : dilatation VD, CCVD et AP, Vmax basse, vena contracta > 5 mm, reflux diastolique dans l’AP, durée de l'IP < 60% de la diastole Sténose pulmonaire (pathologie rare chez l'adulte) - Modérée : Vmax 2.5 – 4 m/s ; ΔP max 25-60 mmHg - Sévère : Vmax > 4 m/s ; ΔP max > 60 mmHg - Indication opératoire : ΔP max > 20 mmHg si VD normal, ΔP max > 40 mmHg si HVD |
| Message pour le chirurgien en cas de pathologie de la valve pulmonaire |
| Description : tricuspidie ou bicuspidie, restriction ou dilatation, fibrose (hyperéchogénicité), hauteur de coaptation ou espacement des feuillets en diastole, aspect de la chambre de chasse (hypertrophie) Dimensions : diamètres de la CCVD, de l’anneau et de l’AP Doppler : dimension du flux couleur (passage CCVD – valve), étendue du jet d’IP, turbulences dans l’AP, Vmax et ?P dans la CCVD (pic télésystolique), la valve (pic proto- ou mésosystolique) et l’AP (reflux diastolique) VD : fonction, taille, degré d’hypertrophie (HVD : sténose pulmonaire) et de dilatation (insuffisance pulmonaire) |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- BONOW RO, CARABELLO B, KARU C, et al. ACC/AHA guidelines for the management of patients with valvular heart disease: Executive summary. Circulation 2006; 114:284-91
- BRUCE CJ, CONNOLLY HM. Right-sided valve disease deserves a little more respect. Circulation 2009; 119:2726-34
- CAPPS SB, ELKINS RC, FRONK DM. Body surface area as a predictor of aortic and pulmonary valve diameters. J Thorac Cardiovasc Surg 2000; 119:975-82
- DENAULT AY, CHAPUT M, COUTURE P, et al. Dynamic right ventricular outflow tract obstruction in cardiac surgery. J Thorac Cardiovasc Surg 2006; 132:43-9
- HAHN RT, ABRAHAM T, ADAMS MS, et al. Guidelines for performing a comprehensive transesophageal echocardiography examination: Recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr 2013; 26:921-64
- KLEIN AL, BURSTOW DJ, TAJIK AJ, et al. Age-related prevalence of valvular regurgitation in normal subjects. A comprehensive color flow examination of 118 volunteers. J Am Soc Echocardiogr 1990; 3:54-63
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- LI W, DAVLOUROS PA, KILNER PJ, et al. Doppler-echocardiographic assessment of pulmonary regurgitation in adults with repaired tetralogy of Fallot: comparison with cardiovascular magnetic resonance imaging. Am Heart J 2004; 147:165-72
- RUDSKI LG, LAI WW, AFILALO J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: A report from the American Society of Echocardiography. J Am Soc Echocardiogr 2010; 23:685-713
- SHILLCUTT SK, TAVAZZI G, SHAPIRO BP, DIAZ-GOMEZ J. Pulmonic regurgitation in the adult cardiac surgery patient. J Cardiothorac Vacs Anesth 2017; 31:215-28
- SHEN T, PICARD MH, HUA L, et al. Assessment of tricuspid annular motion by speckle-tracking in anesthetized patients using transesophageal echocardiography. Anesth Analg 2018; 126:62-7
- TAN CO, HARLEY I. Perioperative transesophageal echocardiographic assessment of the right heart and associated structures: a comprehensive update and technical report. J Cardiothorac Vasc Anesth 2014; 28:1112-33
- YANG H, PU M, CHAMBERS CE, et al. Quantitative assessment of pulmonary insufficiency by Doppler echocardiography in patients with adult congenital heart disese. J Am Soc Echocardiogr 2008; 21:157-64
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
- ZOGHBI WA, ENRIQUEZ-SARANO M, FOSTER E, et al. Recommendations for evaluation of the severity of native valvular regurgitation with two-dimensional and Doppler echocardiography. Eur J Echocardiogr 2003; 4:237-61
