La pompe principale est celle qui assure la propulsion du sang au débit physiologique (2.4 L/min/m2) et à la pression artérielle normale (PAM 60-90 mmHg). Sa plage de débit va de 100 mL/min à 8 L/min. Deux autres pompes servent aux aspirations; l'une est dite gauche (aspiration dans la racine de l'aorte ou le VG), l'autre droite (aspiration dans le champ opératoire). Une ou deux pompes supplémentaires sont utilisées pour perfuser les solutions de cardioplégie. Il existe deux modèles de pompes.
Pompe à galet: elle fonctionne sur le principe de l'occlusion plus ou moins complète d'un tube souple par des galets rotatifs; c'est la plus couramment utilisée. Le débit est fonction du diamètre du tube (en général ¼ pouce chez l'adulte), de la circonférence du support et du nombre de tours/minute de la pompe (50-150 rpm). Le volume systolique varie de 12 à 42 mL/tour. On règle les galets de manière à obtenir une subocclusion qui évite d'écraser les éléments figurés mais qui est suffisante pour propulser la masse sanguine contre une résistance de 300-400 mmHg. Les pompes à galet sont indépendantes de la postcharge: elles maintiennent leur débit quelle que soit la pression artérielle. Malheureusement, elles peuvent pomper de l'air si le réservoir veineux est vide, ou créer une cavitation en amont si le flux d'entrée est restreint. Il existe donc des systèmes de surveillance et d'asservissement pour les arrêter si la pression est trop haute (risque de rupture de la tuyauterie) ou si de l'air s'insinue dans le circuit (risque d'embolie artérielle). La cavitation est due à une dépression locale (en l’occurrence en amont du galet occlusif) qui baisse la solubilité des gaz dissous dans le sang (Figure 7.8).
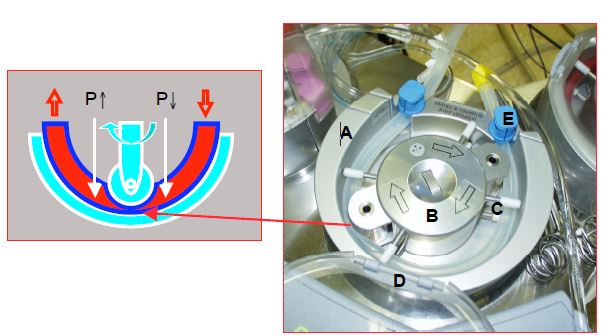
Figure 7.8 : Pompe à galet. A: embase de la pompe; le fait qu'elle représente environ les deux tiers de la circonférence assure une occlusivité constante par les deux galets. B: moyeu central entraînant les deux galets dont l'occlusivité est réglée par la mollette qui se trouve au centre. C: 4 couples de guides maintiennent le circuit dans l'axe. D: couvercle. E: serre-joint du tuyau (à l'entrée et à la sortie de la pompe). Le galet écrase le tuyau, la rotation propulse le sang. Cette pompe est occlusive, ce qui la rend insensible à la postcharge mais crée davantage d’hémolyse et de cavitation à cause des variations de pression entre l’amont et l’aval du galet lors de la compression du tube par le rotor. P: pression dans le tube.
- Pompe centrifuge: elle propulse le sang par l'action d'une turbine rotative (située dans une chambre stérile où passe le sang), tournant à haute vitesse (1'000 - 3'000 rpm) et entraînée par un électro-aimant (situé dans la console de commande). Il en existe différents modèles : BioMedicus™ (Medtronic, USA), CentriMag™ (Levitronix, Suisse), RotaFlow™ (Jostra, Allemagne), Capiox™ (Terumo, USA). La différence de pression entre le centre et la périphérie créée par la force centrifuge à l'intérieur du cône accélère le sang qui est éjecté à l'extérieur [4]. Cette pompe traumatise peu les éléments figurés et réduit la stimulation plaquettaire, mais elle est sensible à la précharge et à la postcharge car elle n'est pas occlusive: une augmentation des résistances artérielles diminue son débit. Pour une pression de sortie de 200 mmHg, par exemple, la pompe débite 4 L/min à 200 tours/min ; si la pression augmente à 400 mmHg, la vitesse de rotation doit s’élever à 3'000 tours/min pour maintenir le même débit. Lorsqu'elle est arrêtée, le circuit artériel doit être clampé sans quoi le sang reflue. Par contre, si plus de 20-30 mL d'air s'introduisent dans le système, le vortex est désamorcé et la force centrifuge baisse; la pompe a tendance à s'arrêter [2]. C'est le système le plus sûr pour des assistances à moyen terme (quelques jours) ou pour aspirer le sang dans le circuit veineux, mais son taux d’utilisation pour les CEC standards est de 30-50% [6,8]. Le coût élevé de ce produit limite son usage (Figure 7.9).

Figure 7.9 : Pompe centrifuge (BioMedicus™). A: Vue générale de la console de commande contenant la tête rotative magnétique mue par un moteur électrique. B: Ecorché de la tête motrice disposable entraînée par la tête rotative magnétique. Le sang est propulsé par la rotation des pales. Le sang rentre par le moyeu (précharge); il est propulsé par un orifice tangentiel, dont le débit est sensible à la postcharge. Le débit de la pompe augmente par augmentation de la vitesse de rotation, mais aussi en augmentant la précharge et en diminuant la postcharge.
En cas de panne du moteur, un système d'entraînement manuel permet d'assurer le débit sanguin de la CEC. Pour les pompes à galet, une manivelle se fixe sur le rotor. Pour les pompes centrifuges, on dispose d'une pompe manuelle acessoire. Dans les deux cas, le maintien du débit demande un effort physique considérable.
La propulsion du sang par une pompe abime les globules rouges et cause une certaine hémolyse. Celle-ci est proportionnelle aux forces de cisaillement endurées par les éléments figurés, au gradient de pression entre l’entrée et la sortie de la pompe et à la durée de la CEC. Elle est plus importante avec les pompes à galet qu’avec les pompes centrifuges. En effet, les premières sont relativement occlusives et créent un fort gradient de pression entre l’amont et l’aval des galets. La majorité des essais contrôlés et randomisés donne un avantage aux pompes centrifuges [6].
Pulsatilité
Ces systèmes ne sont pas pulsatiles. Or la pulsatilité artérielle transmet davantage d'énergie cinétique au sang, ce qui améliore la microcirculation, le flux lymphatique et la perfusion tissulaire. Le risque de thrombose est diminué; la réponse neuro-humorale au stress est freinée; la vasoconstriction induite par la dépulsation est supprimée; la perfusion cérébrale, coronarienne et rénale devrait être améliorée [1,3]. Cependant, ces avantages sont compensés par différents défauts: complexité technique, prix des pompes, jet de très haute vélocité pendant la systole, aggravation de l'hémolyse par un débit qui est > 10 L/min en systole, amortissement de la pulsatilité par l'oxygénateur à membrane et par la canule artérielle, forme de flux peu ressemblante au flux physiologique. Alors que les résultats expérimentaux démontrent une incontestable amélioration de la perfusion capillaire en mode pulsé, les données cliniques chez l’homme concernant la fonction rénale, myocardique et neurologique ne sont guère différentes de ce que l’on obtient en mode dépulsé. Une seule étude randomisée a montré un avantage sur la mortalité et le taux d’infarctus [5], mais aucune n’a relaté de différence sur l’incidence d’ictus et d’insuffisance rénale [1]. Les données actuelles sont trop contradictoires pour pouvoir émettre des recommandations pour ou contre l’utilisation des systèmes pulsatiles [1]. L'apport global de la pulsatilité étant peu signifiant par rapport à l'investissement représenté, ce système est rarement utilisé. D’ailleurs, la pulsatilité n’est pas nécessaire à la perfusion des organes, comme le démontre la comparaison d’assistances ventriculaires pulsatiles (HeartMate XVE™) ou à flux continu (HeartMate II™): la survie à 2 ans est doublée avec le système dépulsé (24% et 58% respectivement) [7]. Ces résultats démontrent que la pulsatilité artérielle devient facultative lorsque le patient est anticoagulé.
| Pompes |
|
Les pompes de CEC sont de deux types:
- Pompe à galets, occlusive, insensible aux conditions de charge, mais provoquant de
l’hémolyse ; risque de cavitation et de propulsion d’air
- Pompe centrifuge, moins traumatisante et moins emboligène, mais sensible aux conditions
de charge
La pulsatilité paraît facultative chez un malade anticoagulé; elle présente davantage de risques mécanique et hémolytique qu’un flux continu. Les données actuelles sont insuffisantes pour émettre des recommandantion favorables ou défavorables aux pompes pulsatiles.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour Avril 2018
Références
- ALGHAMDI AA, LATTER DA. Pulsatile versus nonpulsatile cardiopulmonary bypass flow: an evidence-based approach. J Card Surg 2006; 21:347-54
- HESSEL EA. Cardiopulmonary bypass equipment. In: ESTEFANOUS FG, et al. Eds. Cardiac anesthesia. Principles and clinical practice, 2nd edition. Philadelphia, Lipincott Williams & Wilkins, 2001, 335-86
- HORNICK P, TAYLOR K. Pulsatile and non-pulsatile perfusion: the continuing controversy. J Cardiothorac Vasc Anesth 1997; 11: 310-6
- ISETTA C, CADUSSEAU JL. Circuits de circulation extracorporelle: matériels réutilisables, matériels à usage unique. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris, Arnette Groupe Liaison SA, 2004, 59-86
- MURKIN JM, MARTZKE JS, BUCHAN AM, et al. A randomized study of the iunfluence of perfusion technique and pH management strategy in 316 patients undergoing coronary artery bypass surgery. I Mortality and cardiovascular morbidity. J Cardiothorac Vasc Surg 1995; 110:340-48
- MURPHY GS, HESSEL EA, GROOM RC. Optimal perfusion during cardiopulmonary bypass: an evidence-based approach. Anesth Analg 2009; 108:1394-417
- SLAUGHTER MS, ROGERS JG, MILANO CA, et al. Advanced heart failure treated with continuous-flow left ventricular assist device. N Engl J Med 2009; 361:2241-51
- WARREN OJ, WATRET AL, DE WIT KL, et al. The inflammatory response to cardiopulmonary bypass: Part 2 – Anti-inflammatory therapeutic strategies. J Cardiothorac Vasc Anesth 2009; 23: 384-93
