Même en multipliant les plans de coupe, l'échocardiographie bidimensionnelle (2D) conventionnelle ne permet pas une reconstruction parfaite des structures cardiaques dans l'espace. D'autre part, les calculs hémodynamiques sont tous basés sur des approximations: la section des conduits et des orifices par lesquels passe le sang sont supposés être circulaires, le volume ventriculaire est assimilé à une forme géométrique simple (fraction d'éjection selon Teichholz, par exemple). L'examen 3D permet au contraire d'observer directement l'image en 3 dimensions et de réaliser la planimétrie des conduits, des orifices ou des cavités, quelle que soit leur forme. Le 3D améliore la visualisation des structures, évite la laborieuse reconstruction mentale imposée par plusieurs plans bidimensionnels et facilite grandement la communication avec les opérateurs. Il est particulièrement utile pour la quantification de la masse et des volumes myocardiques, pour l'évaluation de la géométrie complexe du VD ou des cardiopathies congénitales, pour la visualisation anatomique des valves mitrale et aortique, et pour le guidage des procédures semi-invasives intracardiaques (TAVI, Mitraclip, etc). L'évaluation volumétrique du VG indépendamment de toute approximation géométrique permet un calcul fiable du volume systolique et de la fraction d'éjection, bien qu'elle dépende de l'acuité de la détection automatique des contours de la cavité ventriculaire [7].
Physique
La première technique de reconstruction 3D consistait en un processeur externe à la machine d'échocardiographie qui enregistrait une série de coupes à différents degrés de rotation d'une sonde multiplan standard et reconstruisait secondairement l'image volumétrique en la synchronisant au moyen de l'ECG (système Tomtek™). Le processus était lent et de faible résolution. Les nouvelles technologies tridimensionnelles incorporent à la sonde transoesophagienne un capteur matriciel (matrix array) constitué de ≥ 2'500 éléments piézo-électriques de technologie avancée qui acquièrent en temps réel les données d’un volume pyramidal tridimensionnel au lieu d’un plan bidimensionnel (Figure 25.32). Pour limiter l'énergie et la câblerie de transmission, le capteur contient maintenant un pré-processeur miniaturisé qui gère la conversion analogue-digitale et les délais de stimulation ou de réception destinés à construire le front d'onde (voir Figure 25.4). Les informations de 3000 cristaux sont ainsi compressées en 258 "patches" de données qui sont acheminés à l'échocardiographe [2].

Figure 25.32 : Technologie de l'imagerie bi- et tridimensionnelle. A: le transducteur bidimensionnel émet par balayage électronique (flèche rouge) un plan d'analyse selon deux axes: axial (y) et azimutal (x). B: le capteur tridimensionnel émet un vaste volume pyramidal pour analyser son objet selon trois axes: axial (y), azimutal (x) et élévationnel (z). Dans un système 2D, l'élévation est représentée par l'épaisseur (théoriquement nulle) du plan.
Les données brutes sont replacées dans un volume cartésien à 3 dimensions ; chaque point est caractérisé par ses coordonnées selon les axes x, y et z, et par son intensité. Le plus petit volume intégré est appelé un voxel, équivalent du pixel dans le système à 2 dimensions. Un processus électronique appelé segmentation différencie les structures cardiaques par rapport au sang et aux espaces adjacents. La résolution spatiale est de l'ordre de 0.5 mm dans l'axe des ultrasons (y), de 1-2 mm dans l'axe azimutal (x) et de 3 mm en élévation (z) [2].
Pour obtenir un rendu de bonne qualité, l’image doit être d’abord optimalisée en mode 2D avec un gain adéquat (un gain insuffisant laisse des trous en 3D, alors qu’un gain excessif épaissit les structures) et une compression adaptée. Dans le mode en temps réel (live-3D et zoom), plus le volume échantillonné est petit, plus la cadence (frame rate) des images augmente. Une haute densité des lignes d'analyse augmente la résolution spatiale mais freine la cadence d'images. Il s'agit donc de trouver le meilleur compromis entre le volume échantillonné et la densité des lignes pour obtenir la meilleure cadence, car ces trois éléments sont interdépendants [6]. Pour le mode en différé (full-volume), il est recommandé d’ajuster d’abord la zone d’intérêt, le gain et la cadence sur le mode en temps réel avant de procéder à l’acquisition [3]. Les zones les plus profondes sont colorées en bleu, les plus proches en brun. Les algorithmes de lissage permettent un fondu et une continuité de l'image, mais sont sujets à des artéfacts (stitching artefacts), notamment lorsque les mouvements respiratoires ou les arythmies modifient la position des structures par rapport au découpage temporel de l'ECG. La technologie tridimensionnelle est en plein essor. Les prochaines versions permettront une acquisition plus rapide, une cadence d’image plus élevée, une résolution supérieure, une meilleure incorporation du Doppler et une définition automatique des contours.
Modes d'imagerie
La qualité des images 3D est entièrement dépendante de celle des images 2D à partir desquelles elles sont dérivées; de piètres images bidimensionnelles donnent de mauvaises images tridimensionnelles. Les machines d'écho disposent en général de quatre modes différents d'affichage 3D (Figure 25.33) [1,4,6,10].
Physique
La première technique de reconstruction 3D consistait en un processeur externe à la machine d'échocardiographie qui enregistrait une série de coupes à différents degrés de rotation d'une sonde multiplan standard et reconstruisait secondairement l'image volumétrique en la synchronisant au moyen de l'ECG (système Tomtek™). Le processus était lent et de faible résolution. Les nouvelles technologies tridimensionnelles incorporent à la sonde transoesophagienne un capteur matriciel (matrix array) constitué de ≥ 2'500 éléments piézo-électriques de technologie avancée qui acquièrent en temps réel les données d’un volume pyramidal tridimensionnel au lieu d’un plan bidimensionnel (Figure 25.32). Pour limiter l'énergie et la câblerie de transmission, le capteur contient maintenant un pré-processeur miniaturisé qui gère la conversion analogue-digitale et les délais de stimulation ou de réception destinés à construire le front d'onde (voir Figure 25.4). Les informations de 3000 cristaux sont ainsi compressées en 258 "patches" de données qui sont acheminés à l'échocardiographe [2].

Figure 25.32 : Technologie de l'imagerie bi- et tridimensionnelle. A: le transducteur bidimensionnel émet par balayage électronique (flèche rouge) un plan d'analyse selon deux axes: axial (y) et azimutal (x). B: le capteur tridimensionnel émet un vaste volume pyramidal pour analyser son objet selon trois axes: axial (y), azimutal (x) et élévationnel (z). Dans un système 2D, l'élévation est représentée par l'épaisseur (théoriquement nulle) du plan.
Les données brutes sont replacées dans un volume cartésien à 3 dimensions ; chaque point est caractérisé par ses coordonnées selon les axes x, y et z, et par son intensité. Le plus petit volume intégré est appelé un voxel, équivalent du pixel dans le système à 2 dimensions. Un processus électronique appelé segmentation différencie les structures cardiaques par rapport au sang et aux espaces adjacents. La résolution spatiale est de l'ordre de 0.5 mm dans l'axe des ultrasons (y), de 1-2 mm dans l'axe azimutal (x) et de 3 mm en élévation (z) [2].
Pour obtenir un rendu de bonne qualité, l’image doit être d’abord optimalisée en mode 2D avec un gain adéquat (un gain insuffisant laisse des trous en 3D, alors qu’un gain excessif épaissit les structures) et une compression adaptée. Dans le mode en temps réel (live-3D et zoom), plus le volume échantillonné est petit, plus la cadence (frame rate) des images augmente. Une haute densité des lignes d'analyse augmente la résolution spatiale mais freine la cadence d'images. Il s'agit donc de trouver le meilleur compromis entre le volume échantillonné et la densité des lignes pour obtenir la meilleure cadence, car ces trois éléments sont interdépendants [6]. Pour le mode en différé (full-volume), il est recommandé d’ajuster d’abord la zone d’intérêt, le gain et la cadence sur le mode en temps réel avant de procéder à l’acquisition [3]. Les zones les plus profondes sont colorées en bleu, les plus proches en brun. Les algorithmes de lissage permettent un fondu et une continuité de l'image, mais sont sujets à des artéfacts (stitching artefacts), notamment lorsque les mouvements respiratoires ou les arythmies modifient la position des structures par rapport au découpage temporel de l'ECG. La technologie tridimensionnelle est en plein essor. Les prochaines versions permettront une acquisition plus rapide, une cadence d’image plus élevée, une résolution supérieure, une meilleure incorporation du Doppler et une définition automatique des contours.
Modes d'imagerie
La qualité des images 3D est entièrement dépendante de celle des images 2D à partir desquelles elles sont dérivées; de piètres images bidimensionnelles donnent de mauvaises images tridimensionnelles. Les machines d'écho disposent en général de quatre modes différents d'affichage 3D (Figure 25.33) [1,4,6,10].
- Examen simultané sur 2 plans différents (X-Plane); quelle que soit la première image, la deuxième est un plan de 30° à 150° par rapport à la première, affiché en parallèle sur dédoublement de l'écran (split screen). Le Doppler couleur y est superposable.
Vidéo: vue "X-Plane" simultanée d'une valve aortique insuffisante en court-axe et en long-axe.
La cadence d'image est élevée et la résolution spatiale identique à celle du 2D. Les nouvelles machines autorisent l'affichage d'un troisième plan de coupe. - 3D en temps réel (live-3D); le volume exploré est limité à une pyramide rétrécie de 30° x 30-60°, mais de toute la profondeur choisie.
Vidéo: vue "live-3D" de la valve mitrale et de la valve aortique depuis le VG; en diastole, le feuillet mitral antérieur flotte librement entre la chambre d'admission et la chambre de chasse.
Elle permet une cadence de 10-15 images/seconde et une résolution spatiale correcte. Plus le volume investigué est agrandi, plus la cadence et la résolution baissent. Ce mode est utile pour guider l'acquisition en full-volume, pour observer des structures fines et courtes, pour visualiser des évènements brefs, et pour monitorer des gestes chirurgicaux ou des malades arythmiques. - 3D-Zoom; la zone d'intérêt est déterminée par l'opérateur dans les 3 directions de l'espace à partir d'une acquisition biplan (X-Plane) et constitue un volume pyramidal restreint de 20° x 20° à 90° x 90° fonctionnant en temps réel; la cadence est variable selon le volume (10-20 images/sec). L'image obtenue peut être agrandie pour améliorer la visibilité. Par contre, les relations anatomiques avec le voisinage sont perdues.
Vidéo: vue "3D-zoom" de la valve mitrale depuis l'OG; le feuillet antérieur est en-haut, jouxtant la valve aortique, et le feuillet postérieur est en-bas.
- Mode Full Volume; la région d'intérêt délimitée sur l'image 2D habituelle est acquise sous forme d'un volume pyramidal sous un grand angle (de 65°x56° à 102°x105°) avec une haute résolution spatiale et temporelle. Le volume à enregistrer comprend une telle masse de données qu'il est découpé en plusieurs tranches. Chacune est enregistrée au cours d'un cycle cardiaque; plus la boucle est longue (3-16 cycles cardiaques), plus les tranches sont fines et plus la résolution augmente (Figure 25.34). L'image globale est ensuite reconstruite à partir d’une synchronisation avec l’ECG, ce qui demande un certain temps, un rythme cardiaque régulier, l'absence de coagulation ou de mouvement, et l’arrêt de la ventilation; les meilleures images sont obtenues avant le début de la chirurgie. Ce mode offre une reconstruction en boucle avec une cadence d'images rapide (30-40 Hz), mais il n’est pas en temps réel.
Vidéo: vue "full-volume" en reconstruction 3D de la valve mitrale, dite "en-face" c'est-à-dire comme la voit le chirurgien depuis l'OG.
Le Doppler couleur peut y être ajouté pour mesurer la surface de section des jets d'insuffisance ou de sténose, mais les données supplémentaires requises par la couleur restreignent la cadence d'image; les jets de régurgitation ou de sténose sont mesurés dans les deux plans de leur plus faible et de leur plus grande largeur. Ce mode permet ensuite de procéder à des découpes (cropping) et à des rotations permettant des vues selon n’importe quel plan (Figure 25.35). Par exemple, en éliminant des deux tiers du VG et de l'OG, on obtient une vue "en face" de la valve mitrale, qui est analogue à celle du chirurgien dans le champ opératoire. La même manœuvre est réalisable avec la valve aortique vue depuis l'aorte ascendante.

Figure 25.33 : Modes d'affichage 3D. A: examen simultané en 2 plans de la valve mitrale (vues bi-commissurale et long-axe) avec un prolapsus majeur de P2. B: pyramide restreinte (live-3D) centrée sur la valve aortique présentée en court-axe. C: volume limité et isolé de son contexte (zoom), sélectionné au sein de l'image 3D d'une sténose mitrale (affichée comme vue en face depuis l'OG). D: mode full-volume de la même sténose mitrale; la reconstruction en différé permet une cadence d'image supérieure, une meilleure résolution et un volume d'investigation plus grand.

Figure 25.34 : Construction de l'image en Full-volume. Au cours d'un enregistrement de 5 cycles cardiaques, le dispositif ne capture qu'une seule tranche du volume total à scanner par cycle; après 5 cycles, il a acquis l'image complète dont il recolle les tranches en les synchronisant avec l'ECG représentant un seul cycle. En cas de mouvements du patient (respiration) ou d'arythmie, les tranches ne peuvent plus être mises ensemble correctement; il apparaît alors des défauts de collage (stitching artifacts).

Figure 25.35 : Exemple d'imagerie tridimensionnelle de la valve mitrale. A: prolapsus avec bascule (flail) de P2 en vue X-plane (2 plans orthogonaux simultanés). B: bascule du feuillet postérieur en vue live-3D. C: rupture de cordage (flèche) et prolapsus de A3 en reconstruction 3D full volume, après découpage et rotation pour obtenir une vue "en-face" de la valve. D: double jet d'IM fuyant dans l'OG par superposition du flux couleur en imagerie 3D.
Dans la reconstruction full-volume, les volumes des cavités sont représentés de quatre manières différentes pour donner une rendu 3D sur un écran 2D (Figure 25.36) [2].
- Perspective de volume: les zones proches sont en dégradés couleur bronze et les zones profondes en dégradés de bleu, avec un effet d'ombre; malheureusement, la voie transoesophagienne ampute souvent une partie de l'apex du VG.
- Rendu de surface: le volume d'une cavité est rendu par un moulage de celle-ci projeté dans l'espace réalisé à partir d'une définition automatique de l'endocarde.
- Rendu grillagé: grâce à une définition automatique des contours, divers points répartis sur l'endocarde sont reliés par un réseaux de lignes et suivis au cours de la contraction.
- Coupes tomographiques biplanes en série; une structure comme le VG, par exemple, est sectionné en court-axe par tranches de 0.5 mm, chacune étant affichée à l'écran.
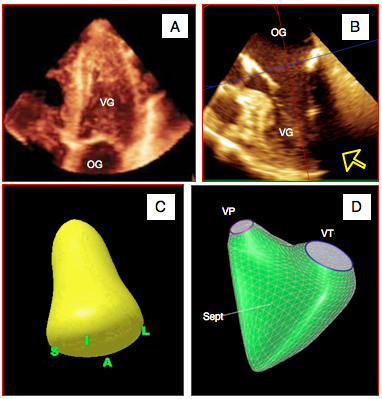
Figure 25.36 : Représentations du volume d'une cavité en 3D. A: perspective de volume avec effet d'ombre du VG en vue transthoracique apicale (reconstruction 3D full-volume). B: amputation fréquente d'une partie de l'apex du VG en vue transoesophagienne. C : moulage de la cavité du VG. D: rendu grillagé de la cavité télédiastolique du VD. Sept: septum interventriculaire. VP: valve pulmonaire. VT: valve tricuspide.
Les programmes semi-automatiques de modelage paramétrique permettent d'extraire des structures comme l'anneau et les feuillets mitraux à partir des données de full-volume préalablement marquées; on peut ensuite y faire une série de mesures, comme les dimensions de l'anneau, son élévation, la hauteur de ballonisation d'un feuillet, le volume de tente ou l'angle mitro-aortique (Figure 25.37) [8,9,10].

Figure 25.37 : Reconstruction paramétrique des structures mitrales. A, B: l'anneau et les feuillets mitraux sont marqués dans 2 plans orthogonaux (vue en coupe et vue en face) avec une vingtaine de points. C: reconstrcution de l'anneau et des feuillets lors d'un prolapsus de P1; les parties teintées en bleu sont situées en-dessous du plan de l'anneau, celles teintées en rouge sont situées au-dessus du plan de l'anneau. D: calcul de l'angle mitro-aortique. E: IM restrictive (type IIIb); l'orifice de régurgitation n'est nullement circulaire comme le présuppose les calculs classiques, mais il a clairement une forme de fente. Le volume contenu entre le plan de l'anneau et les feuillets (volume de tente) est calculé automatiquement. F: prolapsus de P2 (en rouge) et identification du feuillet antérieur en représentation grillagée. A: antérieur. P: postérieur. AL: feuillet antérieur. Ao: anneau de la valve aortique.
Indications
Bien que son application soit en constante expansion, les indications principales du 3D en ETO peuvent être résumées de la manière suivante [2].
- Evaluation précise du volume et de la fonction du VG et du VD;
- Examen détaillé de la valve mitrale;
- Dysfonction d'une prothèse mitrale, endocardite;
- Examen de la valve aortique dans les situations anatomiques complexes;
- Evaluation pré- et post-CEC de plastie ou de correction de cardiopathie congénitale complexe;
- Guidage des interventions semi-invasives sur les valves (TAVI, Mitraclip);
- Mesure de la CCVG avant TAVI chez les patients qui ne peuvent pas avoir un CT-scan;
- Mesure de l'appendice auriculaire gauche ou du septum interauriculaire avant la pose d'un dispositif d'occlusion;
- Situations où l'écho transthoracique ou l'ETO 2D donnent des résultats insuffisants.
Artéfacts
Outre les artéfacts liés à l'analyse bidimensionnelle qui en est la base, l'écho 3D est entaché d'une série de distorsions qui lui sont propres [5,6].
Outre les artéfacts liés à l'analyse bidimensionnelle qui en est la base, l'écho 3D est entaché d'une série de distorsions qui lui sont propres [5,6].
- Erreurs de parallaxe; les mesures linéaires faites à l'écran sur l'image 3D ne tiennent pas compte du relief réel des structures.
- Erreurs de collage (stitching artefacts); la présence d'arythmies ou la survenu de mouvements pendant l'enregistrement des boucles nécessaires à la reconstruction en full-volume aboutit à un alignement incorrect des tranches pyramidales dont l'assemblage reconstitue l'image tridimensionnelle. Cet inconvénient est absent des modes live-3D et zoom.
- Gain inadéquat; la taille d'un orifice peut se modifier avec la variation du gain; un gain excessif la diminue alors qu'un gain insuffisant l'agrandit.
- Lacunes (dropout); un gain insuffisant lors de l'enregistrement peut faire apparaître des trous dans les structures, particulièrement lorsqu'elles ne sont pas perpendiculaires aux ultrasons.
- Ombre (shadowing); le cône d'ombre créé par un objet opaque aux ultrasons peut donner l'impression d'une déchirure ou d'une fente dans la structure sous-jacente.
- Flous (blurring) et rayonnements (blooming); des réflexions anormales à partir de corps étrangers comme des cathéters ou des prothèses les font apparaître plus denses, plus arrondis et plus épais qu'ils ne sont en réalité; elles peuvent aussi en faire varier le diamètre localement. Ce phénomène est essentiellement lié à la résolution dans le plan d'élévation qui est plus faible que celle des autres plans.
- Reverbération; comme en 2D (voir Artéfacts physiques), un objet très échogène peut occasionner l'apparition d'une image en miroir, projetant un rallongement ou un doublement parallèle d'un cathéter, par exemple.
| Echocardiographie tridimensionnelle |
| Le transducteur émet un faisceau d'ultrasons de forme pyramidale dans l'espace (3D), au lieu d'un plan orientable (2D). La grande quantité de données à traiter par le processeur ralentit la cadence d'image proportionnellement à la densité de lignes d'analyse (résolution spatiale) et au volume exploré. L'image est rendue selon quatre modalités. - Affichage simultané de 2 ou 3 plans de la même structure - 3D en temps réel (live-3D): volume pyramidal limité (30° x 60°), cadence 10-15 images/s - 3D-zoom: tranche de volume sélectionnée dans le champ d'exploration global (10-20 images/s) - Full-volume: enregistrement par tranches au cours de 3-12 cycles cardiaques et rendu en différé avec une grande résolution spatiale et temporelle (30-40 images/s); le volume enregistré peut ensuite être découpé selon n'importe quel plan et n'importe quel angle Indications principales: - Evaluation de la valve mitrale - Evaluation de la valve aortique dans les pathologies complexes - Mesure précise du volume et de la fonction du VG et du VD - Evaluation plus précise des pathologies complexes (congénitaux) - Guidage d'interventions intracardiaques (TAVI, Mitraclip) L'imagerie 3D présente certains artéfacts particuliers: - Erreur de parallaxe dans les mesures - Erreurs de collage (stitching) dans la reconstruction - Lacunes dues au manque de gain - Flous (blurring) faisant apparaître certains corps étrangers plus épais que la réalité |
© CHASSOT PG, BETTEX D. Avril 2019; dernière mise à jour, Mars 2020
Références
- AGRICOLA E, BADANO L, MELE D, et al. Real-time three-dimensional transesophageal echocardiography: technical apsects and clinical applications. Heart Intern 2010; 5: e6
- BADANO LP, LANG RM, GONCALVES A. Three-dimensional echocardiography. In: LANCELOTTI P, ZAMORANO JL, HABIB G, BADANO L. The EACVI Textbook of echocardiography. Oxford: Oxford University Press, 2017, 59-69
- FLASCHKAMPF FA, BADANO L, DANIEL WG, et al. Recommendations for transoesophageal echocardiography: update 2010. Eur J Echocardiogr 2010; 11:557-76
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LE HT, HANGIANDREOU N, TIMMERMAN R, et al. Imaging artifacts in echocardiography. Anesth Analg 2016; 122:633-46
- MAHMOOD F, JEGANATHAN J, SARAF R, et al. A practical approach to an intraoperative three-dimensional transesophageal echocardiography examination. J Cardiothorac Vasc Anesth 2016; 30:470-90
- MAHMOOD F, SHERMAN SK. Perioperative transesophageal echocardiography: current status and future directions. Heart 2016; 102:1159-67
- POELAERT JL, BOUCHEZ S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thorac Surg 2016; 50:801-12
- SUGIMOTO T, DULGHERU R, MARCHETTA S, et al. What does 3D echocardiography ass to 2D echocardiography in the assessment of mitral regurgitation ? Curr Cardiol Rep 2017; 19:90
- VEGAS A, MEINERI M. Three-dimensional echocardiography is a major advance for intraoperative clinical management of patients undergoing cardiac surgery: A core review. Anesth Analg 2010; 110:1548-73
