La CIA est la deuxième anomalie congénitale la plus fréquente, après la bicuspidie aortique. Son incidence est de 7% de toutes les anomalies congénitales, et de 30% de celles rencontrées chez l'adulte [9]. Le septum interauriculaire peut présenter cinq types de défauts (Figure 15.10) [3,49].


Figure 15.10 : Vue du septum interauriculaire depuis l'OD, avec l’emplacement des différentes possibilités anatomiques de communications interauriculaires [11,12].
- Ostium secundum situé au centre du septum au niveau de la fosse ovale, représentant 75% des cas;
- Ostium primum: défaut situé près de la valve tricuspide, qui fait partie du canal atrio-ventriculaire (15% des cas);
- Sinus venosus situé à l'origine d'une veine cave (le plus fréquement la VCS), souvent associé à un retour veineux pulmonaire anormal partiel (5-10% des cas);
- Absence de toit du sinus coronaire qui le met en communication avec l'OG (< 1%);
- Cas particulier: foramen ovale perméable (FOP).
Le débit du shunt gauche → droit (G-D) est fonction de sa taille (diamètre de 5 à 30 mm) et de la compliance du VG. La baisse progressive de cette dernière chez l'adulte élève la pression télédiastolique du VG, donc la pression de l'OG; ceci augmente le shunt G-D et accroît la surcharge du VD [6]. Il conduit à une surcharge de volume à droite, donc à une dilatation de l'OD, du VD et de l'AP (Figure 15.11, Figure 15.12 et Figure 15.13).
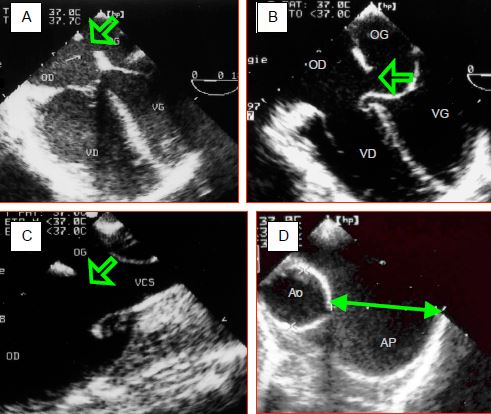
Figure 15.11 : Images échocardiographiques transoesophagiennes de communications interauriculaires (CIA). A : CIA de type ostium secundum, située au milieu de la fosse ovale ; le VD est dilaté. B : CIA de type ostium primum dans le cadre d’un canal AV ; l’aspect ourlé du feuillet septal de la tricuspide indique la fermeture spontanée d’une CIV sous-jacente. C : CIA de type sinus venosus supérieur, située à l’abouchement de la veine cave supérieure (VCS). D : dilatation de l’artère pulmonaire, dont le diamètre mesuré en diastole est presque le double de celui de l’aorte ascendante.

Figure 15.12: Communication interauriculaire. A : Schéma de la silhouette des 4 chambres cardiaques en cas de CIA avec un shunt gauche → droit important (flèche). L'OD et le VD sont dilatés; le VD est hypertrophié. L’apex du cœur est formé par le VD, non par le VG. B : Vue échocardiographique tridimensionnelle du septum interauriculaire depuis l’OD, avec une CIA de type ostium secundum en son centre.

Figure 15.13: Images échocardiographiques transoesophagiennes du flux Doppler couleur à travers deux CIA situées au milieu de la membrane de la fosse ovale (ostium secundum) ; le flux du shunt va de l’OG vers l’OD (shunt G-D). A: grande CIA non-restrictive, large ouverture, flux de basse vélocité. B: petite CIA restrictive, avec flux accéléré. Malgré la différence de vélocité, la volume shunté est plus grand dans le premier cas.
Le VD est dilaté et hypertrophié pour accommoder la surcharge de volume. Le diamètre la l'AP est plus grand que celui de l'aorte, et le flux y est accéléré. Le rapport normal de 0.6 entre les dimensions droites et gauches et entre la vélocité de l'AP et celle de l'aorte est plus que doublé. Le diagnostic échocardiographique est posé sur un défaut visible dans le septum (Figure 15.11), un flux systolo-diastolique entre les deux oreillettes (Figure 15.13) et une dilatation des chambres droites (Vidéos).
Vidéo: Flux couleur illustrant le shunt gauche - droit dans une CIA ostium secundum; le flux va de l'OG (en haut de l'écran) à l'OD (en bas).
Vidéo: Hypertrophie dilatative du VD due à la surcharge de volume causée par la CIA; le VD est plus grand que le VG (vue 4-cavités).
Le flux à travers le shunt a un aspect biphasique typique (Vmax 0.5-1.5 m/s): il présente un pic télésystolique – protodiastolique correspondant à l'onde "v" et un pic durant la contraction auriculaire correspondant à l'onde "a" [5,11]. Entre deux, il existe deux périodes pendant lesquelles le flux est ralenti, voire renversé; elles correspondent aux descentes de pression "x" et "y" (Figure 15.14) [24,32].

Figure 15.14: Représentations spectrales du flux à travers une CIA; le shunt est à large prédominance gauche – droit. Le flux principal est situé en dessous de la ligne de base, puisqu’il va de l’OG vers l’OD en s'éloignant du capteur échocardiographique situé dans l'œsophage ; il présente deux composantes (flèches jaunes). On voit aussi deux petites composantes de sens opposé (droite - gauche) au-dessus de la ligne de base (flèches vertes).
Cette morphologie est liée à l'évolution des pressions dans les oreillettes au cours du cycle cardiaque [30]. En effet, l'amplitude des variations de pression est plus grande dans l'OG que dans l'OD: la pression est donc plus élevée à gauche qu'à droite pendant les pics de pression, mais plus basse pendant les nadirs de pression, ce qui permet une inversion du flux à ce moment (Figure 15.15) [5].

Figure 15.15: Représentation des courbes de pression de l'OG (rouge) et de l'OD (jaune). Les variations de pression sont plus amples à gauche. De ce fait, la POG est plus élevée que la POD lors des pics de pression, mais plus basse lors de nadirs de pression. Le flux sera donc gauche - droit pendant les ondes a et v (flèches rouges), mais droite - gauche pendant les descentes x et y (flèches bleues) [30].
Le renversement le plus significatif a lieu en systole, car la descente de l'anneau mitral provoque une augmentation brusque du volume de l'OG et une diminution importante de sa pression. La composante D-G du shunt s'accentue lorsque le remplissage de l'OD augmente à la faveur d'une chute de la pression endothoracique (relaxation après Valsalva, manoeuvre de Müller); il en est de même lorsque la pression de l'OD augmente parce que la postcharge et la pression de remplissage du VD s'élèvent, comme pendant un Valsalva, un inspirium en IPPV ou une PEEP (Figure 15.16) [24]. Ainsi même un shunt à prédominance G-D peut occasionner une embolie paradoxale à la faveur d'une manoeuvre de Valsalva ou d'une PEEP excessive (Vidéo et Figure 15.17).
En anesthésie, ceci oblige à une "chasse aux bulles" dans toutes les voies veineuses pour éviter des embolies gazeuses cérébrales ou coronaires.
En anesthésie, ceci oblige à une "chasse aux bulles" dans toutes les voies veineuses pour éviter des embolies gazeuses cérébrales ou coronaires.

Figure 15.16: Effet de la ventilation sur le flux d'une CIA. En apnée (A), le flux est presque exclusivement gauche - droit. En IPPV (B), la vélocité du flux gauche – droit diminue. L'adjonction de 10 cm H2O de PEEP (C) réduit encore la composante gauche - droite, et augmente la composante droite - gauche. Malgré une ventilation adéquate, la saturation artérielle va baisser.
Vidéo: Passage spontané de microbulles de l'OD vers l'OG dans une CIA ostium secundum.

Figure 15.17 : Lorsque la pression dans l'OD est momentanément supérieure à celle de l'OG, le flux se renverse à travers la CIA (flèche); une embolie paradoxale peut survenir à ce moment, comme l'indique le passage de microbulles de l'OD dans l'OG en présence de PEEP. VAo : valve aortique.
Une petite CIA peut rester asymptomatique fort longtemps; le seul indice est un souffle systolique 3/6 de haut débit à travers la valve pulmonaire, que l'on entend au bord supérieur gauche du sternum, et un deuxième bruit dédoublé et fixe. L'ECG présente une déviation axiale droite et la radiographie du thorax un agrandissement des cavités droites et du bord de l'AP. Mais les adultes présentent le plus souvent une dyspnée d'effort, des arythmies sus-jonctionnelles et des épisodes de décompensation droite. Les CIA associées à une augmentation de plus de 50% du flux pulmonaire (Qp : Qs > 1.5), à des embolies paradoxales et à une dilatation droite doivent être fermées afin de prévenir les arythmies (tachyarythmies sus-jonctionnelles) et la dilatation du VD qui conduit à long terme à une décompensation droite [18,26].
La surcharge de volume dilate le VD et l'anneau tricuspidien; ceci provoque une insuffisance tricuspidienne, en général de degré 1-2 sur 4. S'il est très important, le shunt induit une hypertension artérielle pulmonaire (HTAP) modérée (rarement > 500 dynes•s•cm-5), une hypertrophie puis une défaillance du VD. Dans ce cas, le débit du shunt diminue, comme le gradient de pression entre l'OG et l'OD; le shunt devient bidirectionnel. Il peut même s'inverser, et le malade devient cyanosé. Toutefois, le syndrome d'Eisenmenger (HTAP fixée) est rare : il survient chez moins de 5% des malades de plus de 40 ans [3,9]. Une insuffisance mitrale apparaît dans 15% des cas non-opérés [31].
L'indication opératoire est posée sur la présence d'un shunt G-D important (Qp/Qs ≥ 1.5:1), de la dilatation du VD, de la dyspnée et/ou de l’anamnèse d’embolies paradoxales [3,45]. Le sinus venosus accompagné d'un retour veineux pulmonaire anormal doit être opéré quelle que soit sa taille à cause du risque élevé d'HTAP [6].
Lorsqu'elles sont centrales (ostium secundum ou FOP) et entourées de bords de bonnes dimensions (≥ 5 mm), les CIA de moins de 40 mm sont occluses par une prothèse de type ombrelle placée par voie percutanée (occluders Amplatzer™, PFO Star™, Helex™, etc), en général sous contrôle d'une échocardiographie transoesophagienne [3,6,13,43,49]; cette implantation est suivie d'une bithérapie antiplaquettaire pendant 6 mois et d'aspirine à vie. Lorsqu’elles sont grandes ou d’un autre type que l’ostium secundum (ostium primum, sinus venosus), les CIA sont fermées par voie chirurgicale (patch de péricarde autologue ou fermeture directe) ; la mortalité opératoire est < 1% [3]. Le devenir optimal est assuré par une fermeture de la CIA avant l’âge de 25 ans, mais seule une opération conduite avant l'âge de 5 ans assure un devenir sans aucune séquelle. Chez le patient de > 60 ans, le risque de complications est plus élevé (12-23%), mais le VD bénéficie toujours de l'intervention, bien qu'il ne puisse plus retrouver une taille et une fonctioin normales [22]. En présence d’HTAP, la fermeture d’une CIA n’est indiquée que si le shunt est majoritairement G-D, si la PAPsyst est < 0.5 PAsyst et si le rapport RAP/RAS est < 0.65, ce qui est très généralement le cas [3,43,45,49]. La fermeture est contre-indiquée si le shunt est D-G ou les RAP > 0.65 RAS [45].
Foramen ovale perméable (FOP)
Un FOP est une découverte courante dans la population normale; son incidence varie de 5-17% avec l'échocardiographie bidimensionnelle, à 24% lors d'autopsie ou à 27% lors d'inspection directe peropératoire, où il se présente comme une fente d’environ 20 mm [2,4,25,28,42]. Il est fréquemment associé à une élongation de la membrane de la fosse ovale formant une membrane flottante (63% des cas) ou à un anévrysme du septum interauriculaire (42% des cas) [1]. Normalement, la membrane de la fosse ovale fusionne avec la partie fibro-musculaire du septum interauriculaire dans la première année de vie. Lorsque cette fusion n'a pas lieu, la membrane est simplement accolée par le jeu de la pression plus haute de l'OG; elle laisse en général un petit passage sous forme d'un shunt G-D permanent mais minime. Mais si la pression de l'OD devient momentanément supérieure à celle de l'OG (manoeuvre de Valsalva, PEEP, embolie pulmonaire), le FOP s'ouvre par bascule de la membrane dans l’OG et constitue alors un shunt D-G qui présente un risque de désaturation artérielle et d'embolisation systémique (Vidéo) [47].
Vidéo: Thrombus enclavé dans un foramen ovale perméable lors d'une embolie pulmonaire massive; la surcharge de pression droite a renversé le flux du FOP en un shunt droit - gauche.
Le FOP se diagnostique à l'échocardiographie par la présence d'un flux couleur (Figure 15.18) et par un test aux microbulles (Figure 15.19) [2,33].
- Le Doppler couleur met en évidence un flux de shunt G → D dans 80% des FOP;
- L'épreuve de contraste permet de détecter l’éventuelle composante D → G du shunt (Vidéo).

Figure 15.18: Foramen ovale perméable (FOP). Image ETO du flux couleur qui passe entre la membrane de la fosse ovale et la partie fibro-musculaire du septum interauriculaire. Ao : valve aortique.
Vidéo: Test aux microbulles; passage droit - gauche par bouffée lorsque la POD est supérieure à la POG au cours du cycle cardiaque.

Figure 15.19: Test aux microbulles. Image du passage de microbulles depuis l'OD vers l'OG. L'OD (comme le VD) est remplis de contraste; à chaque cycle cardiaque, une bouffée de microbulles est éjectée dans l'OG à travers le FOP. Le traitillé jaune indique la position du septum interauricuaire.
L’épreuve de contraste se fait par l'injection rapide, de préférence par voie centrale, de 10 ml NaCl 0.9% dans lesquels on a créé des microbulles par cavitation entre deux seringues. Elle démontre une opacification de l'OD et une apparition immédiate de microbulles dans l'OG et dans l'aorte; si ces dernières arrivent dans l'OG plus de 5 cycles cardiaques après leur apparition dans l'OD, elles sont probablement dues au passage transpulmonaire. Pour favoriser le passage D-G, on réalise deux manœuvres différentes [19].
- Une augmentation de pression dans l’OD en élevant la postcharge du VD par une PEEP importante (20-25 cm H2O) ou un Valsalva;
- Une augmentation de volume de l’OD en relâchant brusquement la pression dans les voies aériennes ; ceci a pour effet d'augmenter le retour veineux vers l'OD mais de freiner momentanément celui vers l'OG.
Ces deux manoeuvres de provocation augmentent le taux de diagnostic à 92% des FOP [1,2].
Le FOP comme la CIA, peut donner lieu à des embolies paradoxales, bien plus rares que l'incidence de la lésion, puisqu'elles surviennent dans 1-2% des cas seulement [7]. Ces embolies peuvent quelquefois conduire à des accidents vasculaires cérébraux [29]. Elles surviennent probablement pendant des manoeuvres de Valsalva, en cas d'hypertension pulmonaire aiguë sur embolie pulmonaire massive, ou en cas d'embolisation gazeuse, par exemple lors de coelioscopie, d'interventions neurochirurgicales en position assise (12-39% des cas) ou de décompression après plongée sous-marine [8,16]. La plongée sous-marine non-professionnelle n’est toutefois pas considérée comme une indication à une recherche systématique de FOP ni à sa fermeture [48]. Les embolies paradoxales sont favorisées par la présence d’un anévrysme du septum interauriculaire, par la persistance de la membrane d’Eustache, qui dévie le sang de la VCI vers le FOP, et par les arythmies sus-jonctionnelles [23].
Le problème majeur du FOP est son degré d’association à un AVC de nature embolique. De nombreux travaux démontrent que la lésion est significativement corrélée à des AVC cryptogéniques (OR 3.0 - 3.7) [7,20,39]. Lors d’embolie pulmonaire, par exemple, la présence d’infarctus cérébraux silencieux est plus fréquente chez les malades porteurs de FOP (OR 34.9) [14], et la mortalité de ces derniers est 3 fois plus élevée que celle des malades sans FOP [27]. La relation est plus étroite lorsque le FOP est associé à un anévrysme du septum interauriculaire (OR 15.6) [39]. Il semble aussi exister une relation avec la migraine réfractaire avec aura [23]. Toutefois, la prévalence de FOP dans les cas d'AVC ischémique sans source évidente d'embolisme est de 35-40%, alors qu'elle est de 20-25% dans la population générale; cette faible différence laisse planer le doute d'une relation fortuite [21].
Fermer ou non un FOP après un AVC d'origine embolique est un problème qui n'a toujours pas de solution claire. Après plusieurs travaux démontrant une égalité de résultat dans les risques de récidive d'ictus entre la fermeture percutanée par une ombrelle ou le traitement médical (anticoagulant ou antiplaquettaire) [17,35], plusieurs études randomisées récentes tendent à démontrer une supériorité du traitement interventionnel dans la prévention des récidives: hazard ratio 0.49 [10], 0.38 [41], 0.23 [44] ou 0.03 [34] en faveur de la thérapie invasive. Les risques liés à la procédure sont bas (1.5-5.9%) [10,34]; mais le taux de FA après fermeture est de 4.6-6.6% [34,44]. Les résultats plus tranchés des derniers essais sont probablement liés à une sélection plus stricte des malades (large FOP avec anévrysme septal, absence de cause intercurrente d'ictus, âge < 60 ans, CT-scan ou IRM précoce avec image d'AVC ischémique non-lacunaire) et à la présence d'un traitement antiplaquettaire et/ou anticoagulant. Actuellement, on tend à considérer la fermeture de FOP par cathétérisme comme le traitement de premier choix pour la prévention d'une récidive d'ictus lorsqu'il n'existe pas d'évidence d'une autre étiologie à ce dernier et que le FOP est majeur [21,38].
La découverte fortuite d'un FOP lors de chirurgie cardiaque pose la question de sa fermeture au cours de la CEC, ce qui implique une double canulation veineuse et un prolongement de l'intervention. Une enquête a montré que 28% des opérateurs le fait systématiquement, mais que la majorité ne ferme le FOP que s'il est de grande taille, si le malade a une anamnèse d'embolie artérielle, ou si la pression dans l'OD est élevée [46]. La fermeture peropératoire d’un FOP asymptomatique ne modifie pas la morbi-mortalité postopératoire, mais semble au contraire augmenter le risque d’AVC (OR 2.47) [28]. D’ailleurs, les recommandations restent très conservatrices sur l’indication à occlure un FOP, qui n’est proposée que lors d’embolie paradoxale occasionnant un AVC cryptogénique ou des occlusions artérielles à répétition [6,15,36,37]. En effet, les données cliniques ne sont pas assez robustes pour déterminer une relation de cause à effet directe entre le FOP et l’AVC, et la fermeture d’un FOP n’exclut pas la récidive d’ictus ni celle d’embolie paradoxale. La découverte fortuite d’un FOP asymptomatique à l’ETO peropératoire ne peut donc inciter à sa fermeture "en passant" que si certaines conditions sont remplies [40].
- Intervention de chirurgie cardiaque impliquant une atriotomie;
- Taille de l'orifice importante ou membrane de la fosse ovale trop courte pour permettre l'occlusion (situation voisine d'une CIA);
- Fort passage au Doppler couleur;
- Shunt bidirectionnel;
- Présence d’un anévrysme du septum;
- Risque que la POD soit supérieure à la POG: insuffisance droite, hypertension pulmonaire, BPCO, baisse de la POG après correction d'une valvulopathie mitrale;
- Greffon pour transplantation cardiaque, pose d'une assistance ventriculaire gauche.
Anesthésie en cas de CIA
L’impact de la CIA sur le déroulement de l’anesthésie dépend de l'importance du shunt, de sa direction préférentielle et de la présence d'une éventuelle hypertension pulmonaire (HTAP) (Tableau 15.3) [12].

- La prise en charge hémodynamique vise à réduire l'importance du shunt. On l'obtient par une baisse des résistances artérielles systémiques (RAS) et une légère augmentation des résistances artérielles pulmonaires (RAP) (Figure 15.20). Pour autant qu'il n'y ait pas d'HTAP, ceci s’obtient par vasodilatation systémique et discrète hypoventilation (FiO2 0.3, PaCO2 45 mmHg).

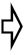

Figure 15.20: Shunt gauche → droit. Il augmente lorsque les RAS s’élèvent et que les RAP baissent ; le flux pulmonaire (Qp) est alors excessif. Le shunt diminue si les RAS baissent et si les RAP augmentent ; c’est le but visé en anesthésie. La compliance du VG diminuant avec l'âge, la pression télédiastolique du VG tend à s'élever, ce qui augmente la pression de l'OG et renforce le shunt G-D.
- La ventilation en pression positive (IPPV) et, a fortiori la PEEP, élèvent la postcharge du VD; elles freinent la composante G-D du shunt mais augmentent la composante D-G; lors de shunt partiellement bidirectionnel, elle peuvent induire une désaturation artérielle. Il est recommandé de ventiler à basse pression avec une FiO2 de 0.3, en maintenant une légère hypercapnie.
- En cas d'HTAP, la ventilation en pression positive augmente encore la postcharge droite. Toutefois, cette augmentation de pression est faible par rapport à la pression pulmonaire au repos; elle représente même une plus faible augmentation de postcharge que chez un individu normal. D'autre part, la ventilation contrôlée permet de baisser les RAP par hyperventilation et hypocapnie (voir Hypertension pulmonaire).
- La vasodilatation artérielle systémique baisse les pressions gauches et diminue le volume du shunt G-D. De ce point de vue, l'isoflurane et l'anesthésie loco-régionale rachidienne sont de bons choix. Mais si le shunt est déjà bidirectionnel parce que la surcharge droite a induit une HTAP, c'est la composante D-G du shunt qui va augmenter, et avec elle la désaturation artérielle.
- L'hypovolémie est mal supportée, car le patient a besoin d'un haut volume circulant pour maintenir son débit systémique, vu qu'une partie du volume est obligatoirement séquestrée par le shunt entre l'OD et l'OG via le circuit pulmonaire à basse pression; ceci est d'autant plus marqué que les RAS sont élevées.
- La mesure de PVC est un piètre indice de précharge, car la POD est élevée à cause du shunt et de l'éventuelle insuffisance tricuspidienne.
- Le VD a besoin d'une précharge d'autant plus importante qu'il est hypertrophié. La fonction ventriculaire droite peut être améliorée en augmentant la contractilité et la fréquence (dobutamine, milrinone).
- Toute élévation de pression dans l'OD augmente le risque d'embolie paradoxale; celle-ci peut survenir sur thrombo-embolie périphérique ou sur injection intempestive d'air ou de particules par des voies veineuses. Il faut méticuleusement éliminer toute bulle d’air dans les perfusions.
- La dysfonction diastolique du VG fréquente chez l'adulte élève la pression télédiastolique du VG, donc la pression de l'OG; ceci augmente le shunt G-D et accroît la surcharge du VD [6].
- La fermeture d’une CIA rend le malade brusquement hypervolémique : le volume précédemment "volé" dans le circuit pulmonaire par le shunt et ne circulant qu’entre l’OD et l’OG se retrouve additionné au volume circulant systémique.
| Communication interauriculaire (CIA) |
|
Caractéristiques:
- Shunt G → D non cyanogène avec augmentation du débit pulmonaire (Qp ↑, Qp/Qs > 1.5)
- Petite composante D → G possible (risque ↑ si HTAP ou ↑ P OD)
- Dilatation des chambres de réception: OD, VD, AP
- Surcharge de volume pour le VD
- HTAP peu fréquente (< 10% des adultes: RAP 300-500 dynes•cm•s-5)
- Indications opératoires: Qp/Qs > 1.5, dilatation du VD, dyspnée, arythmie
Indications à la fermeture d’un FOP: embolie paradoxale occasionnant un AVC ou des occlusions artérielles. En cours d’opération cardiaque: FOP bidirectionnel, atriotomie et risque de POD > POG.
Pour diminuer le shunt, il faut baisser les RAS et augmenter les RAP
Recommandations pour l’anesthésie:
- AG avec isoflurane
- ALR rachidienne (rachianesthésie, péridurale)
- Ventilation: FiO2 0.3, normo- ou discrète hyper-carbie, P ventil basse, pas de PEEP
- Hypovolémie mal tolérée à cause de la séquestration de volume dans la circulation pulmonaire
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Décembre 2019
Références
- AGOUSTIDES JG, WEISS SJ, OCHROCH AE, et al. Analysis of the interatrial septum by transesophageal echocardiography in adult cardiac surgical patients: Anatomic variants and correlation with patent foramen ovale. J Cardiothorac Vasc Anesth 2005; 19:146-9
- AGOUSTIDES JG, WEISS SJ, WEINER J, et al. Diagnosis of patent foramen ovale with multiplane transesophageal echocardiography in adult cardiac surgical patients. J Cardiothorac Vasc Anesth 2004; 18:725-30
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BERKOMPAS DC, SAGAR KB. Accuracy of color Doppler trasesophageal echocardiography for diagnosis of patent foramen ovale. J Am Soc Echocardiogr 1994; 7:253-6
- BETTEX D, CHASSOT PG. Malformations congénitales de l'adulte. In: BETTEX D, CHASSOT PG. Echocardiographie transoesophagienne en anesthésie – réanimation. Paris: Pradel-Masson, Williams & Wilkins, 1997, 171-87
- BHATT AB, FOSTER E, KUEHL K, et al. Congenital hesart disease in older adult. A Scientific Statement from the American Heart Association. Circulation 2015; 131:1884-931
- BOGOUSSLAVSKI J, GARAZI S, JEANRENAUD X, et al. Stroke recurrence in patients with patent foramen ovale: the Lausanne study. Neurology 1996; 46:1301-5
- BOVE AA. Risk of decompression sickness with patent foramen ovale. Undersea Hyperb Med 1998; 25:175-8
- BRECKER SJD, REDINGTON A, SHORE D, OLDERSHAW P. Atrial septal defects. In: REDINGTON A, ed. Congenital heart disease in adults. A practical guide. London: WB Saunders Co Ltd, 1994, 104-10
- CARROLL JD, SAVER JL, THALER DE, et al. Closure of patent foramen ovale versus medical therapy after cryptogenic stroke. N Engl J Med 2013; 368:1092-100
- CHASSOT PG, BETTEX D. Perioperative transoesophageal echocardiography in adult congenital heart disease. In: POELAERT J, SKARVAN K. Transoesophageal echocardiography in anaesthesia. London, BMJ Book, 2004
- CHASSOT PG, BETTEX DA. Anesthesia and adult congenital heart disease. J Cardiothorac Vasc Anesth 2006; 20:414-37
- CHESSA M, CARMINATI M, BUTERA G, et al. Early and late complications associated with transcatheter occlusion of secundum atrial septal defect. J Am Coll Cardiol 2002; 39:1061-5
- CLERGEAU MR, HAMON M, MORELLO R, et al. Silent cerebral infarcts in patients with pulmonary embolism and a patent foramen ovale. A prospective diffusion-weighed MRI study. Stroke 2009; 40:3758-62
- ESO – European Stroke Organisation. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis 2008; 25:457-507
- FAHTI AR, ESHTEHARDI P, MEIER B. Patent foramen ovale and neurosurgery in sitting position: a systematic review. Br J Anaesth 2009; 102:588-96
- FURLAN AJ, REISMAN M, MASSARO J, et al. Closure or medical therapy for cryptogenic stroke with patent foramen ovale. N Engl J Med 2012; 366:991-9
- GATZOULIS MA, FREEMAN MA, SIU SC, et al. Atrial arrhythmia after surgical closure of atrial septal defect in adults. N Engl J Med 1999; 340:839-44
- GREIM CA, TRAUTNER H, KRAMER K, et al. The detection of interatrial flow patency in awake and anesthetized patients: A comparative study using transnasal echocardiography. Anesth Analg 2001; 92:1111-6
- HANDKE M, HARLOFF A, OLSCHEWSKI M, et al. Patent foramen ovale and cryptogenic stroke in older patients. N Engl J Med 2007; 357:2262-8
- HANKEY GJ, McQUILLAN BM. Patent foramen ovale closure. The pendulum swings. Circulation 2018; 137:1991-3
- HANNINEN M, KMET A, TAYLOR DA; et al. Atrial septal defect closure in the elderly is associated with excellent quality of life, functional improvement, and ventricular remodelling. Can J Cardiol 2011; 27:698-704
- HORTON SC, BUNCH TJ. Patent foramen ovale and stroke. Mayo Clin Proc 2004; 79:79-88
- JAFFE RA, PINTO FJ, SCHNITTGER I, et al. Aspects of mechanical ventilation affecting interatrial shunt flow during general anesthesia. Anesth Analg 1992; 75:484-8
- KONSTADT SN, LOUIE EK, BLACK S. Intraoperative detection of foramen ovale by transesophageal echocardiography. Anesthesiology 1994; 74:212-6
- KONSTANTINIDES PJ, ANDERSON ME, ROTTMAN JN, et al. A comparison of surgical and medical thrapy for atrial septal defects in adults. N Engl J Med 1995; 333:469-73
- KONSTANTINIDES S, GEIBEL A, KASPER W, et al. Patent foramen ovale is an important predictor of adverse outcome in patients with major pulmonary embolism. Circulation 1998; 97:1946-51
- KRASUSKI RA, HART SA, ALLEN D, et al. Prevalence and repair of intraoperatively diagnosed patent formane ovale and association with perioperative outcomes and long-term survival. JAMA 2009; 302:290-7
- LECHAT P, MAS JL, LASCAULT G, et al. Prevalence of patent formane ovale in patients with stroke. N Engl J Med 1988; 318:1148-52
- LEVIN AR. Atrial pressure-flow dynamics in atrial septal defects (secundum type). Circulation 1968; 37:476-9
- LIBERTHSON RR, BOUCHER CA, FALLON JT, et al. Severe mitral regurgitation: A common occurence in the aging patient with secundum atrial septal defect. Clin Cardiol 1981; 4:229-32
- LIN FC, FU M, YEH SH, WU D. Doppler atrial flow patterns in patients with secundum atrial septal defects. Determinants, limitations and pitfalls. J Am Soc Echocardiogr 1988; 1:141-5
- LOUIE EK, KONSTADT SN, RAO TL. Transesophageal echocardiographic diagnosis of the right to left shunting across the foramen ovale in adults without prior stroke. J Am Coll Cardiol 1993; 21:1231-7
- MAS JL, DERUMEAUX G, GUILLON B, et al. Patent foramen ovale closure or anticoagulation vs antiplatelet after stroke. N Engl J Med 2017; 377:1011-21
- MEIER B, KALESAN B, MATTLE HP, et al. Percutaneous closure of patent foramen ovale in cryptogenic embolism. N Engl J Med 203; 368:1083-91
- MEIER B, LOCK JE. Contemporary management of patent foramen ovale. Circulation 2003; 107:5-9
- MESSÉ S, GRONSETH G, KENT D, et al. Practice advisory: recurrent stroke with patent formaen ovale (update of practice parameters): report of the Guideline Development, Dissemination, and Implementation Subcomittee of the American Academy of Neurology. Neurology 2016; 87:815-21
- MOJADIDI MK, ZAMAN MO, ELGENDY IY, et al. Cryptogenic stroke and patent foramen ovale. J Am Coll Cardiol 2018; 71:1035-43
- OVERELL JR, BONE I, LEES KR. Interatrial septal abnormalities and stroke: a meta-analysis of case-control studies. Neurology 2000; 55:1172-9
- PATEL PA, HALL A, AUGOUSTIDES JGT, et al. Dynamic shunting across a patent formaen ovale in adult cardiac surgery – Perioperative challenges and management. J Cardiothorac Vasc Anesth 2018; 32:542-9
- SAVER JL, CARROLL JD, THALER DE; et al. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke. N Engl J Med 2017; 377:1022-32
- SCHNEIDER B, ZIENKIEWICZ T, JANSEN V, et al. Diagnosis of patent foramen ovale by transesophageal echocardiography and correlation with autopsy findings. Am J Cardiol 1996; 77:1202-9
- SILVERSIDES CK, DORE A, POIRIER N, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Shunt lesions. Can J Cardiol 2010; 26:e70-e79
- SØNDERGAARD L, KASNER SE, RHODES JF, et al. Patent foramen ovale closure or antiplatelet therapy for cryptogenic stroke. N Engl J Med 2017; 377:1033-42
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- SUKERNIK MR, GOSWAMI S, FRUMENTO RJ, et al. National survey regarding the management of an intraoperatively diagnosed patent foramen ovale during coronary artery bypass graft surgery. J Cardiothorac Vasc Anesth 2005; 19:150-4
- SUKERNIK MR, METS B, BENNETT-GUERRERO E. Patent foramen ovale and its significance in the perioperative period. Anesth Analg 2001; 93:1137-46
- TORTI S. L’importance du formane ovale perméable en plongée, avec les recommendations 2007 de la Société Suisse de Médecine Subaquatique et Hyperbare. Forum Med Suisse 2007; 7:975-7
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
