L'évolution clinique de la plupart des cardiopathies congénitales est bien meilleure si celles-ci sont corrigées en bas âge. Cette attitude confronte les anesthésistes avec des enfants de moins d'un an dont le cœur, les organes et la régulation hémodynamique ne sont pas encore pleinement développés.
Particularités du cœur néonatal
A la naissance, les deux ventricules sont de la même taille et de la même épaisseur, mais le VG doit très vite accommoder une augmentation de sa postcharge, alors que celle du VD diminue puisque la PAP atteint sa valeur normale dès la fin du 2ème mois de vie. Le VG s’hypertrophie, et sa masse est environ le double de celle du VD à 6 mois [8].
Le cœur du nouveau-né est immature. Il contient moins de fibres contractiles que celui de l’adulte (30% versus 60%) ; celles-ci sont peu organisées. Il développe moins de tension par unité de masse que celui de l’adulte. L’innervation sympathique est incomplète, et les réserves de catécholamines sont faibles. La densité des récepteurs β1 est pauvre, les récepteurs α1 prédominent ; chez les enfants cyanosés, la concentration des récepteurs β2 est également diminuée [10]. En cas de stress important, la contractilité myocardique et le tonus vasculaire périphérique dépendent donc largement d’un apport exogène de catécholamines par les surrénales. La baisse de récepteurs β explique la meilleure efficacité de l’adrénaline (effet α1) et de la milrinone (voie indépendante des récepteurs β) par rapport à la dopamine ou la dobutamine. Par contre, l’innervation parasympathique est normale, d’où la prédominance vagale chez le nouveau-né. L’immaturité du système réticulo-sarcoplasmique comme source de Ca2+ libre pour la contraction myocardique fait que le petit enfant dépend du transport membranaire de Ca2+ pour activer la tropomyosine; il développe donc une force contractile moindre et une relaxation ralentie, et dépend davantage d’un apport extérieur de Ca2+ en cas de stress hémodynamique [2]. Le myocarde infantile est donc très sensible aux interférences avec le métabolisme calcique. De ce fait, les bloqueurs calciques sont contre-indiqués pendant la première année de vie, et les solutions de cardioplégie sont préférentiellement hypocalcémiques [1]. Le coeur du nouveau-né dépend largement de la glycolyse et du lactate, mais très peu de l'oxydation des acides gras, comme source d'énergie. Cette relative capacité à fonctionner par glycolyse anaérobe le rend plus résistant à l'ischémie.
Le cœur du nouveau-né est immature. Il contient moins de fibres contractiles que celui de l’adulte (30% versus 60%) ; celles-ci sont peu organisées. Il développe moins de tension par unité de masse que celui de l’adulte. L’innervation sympathique est incomplète, et les réserves de catécholamines sont faibles. La densité des récepteurs β1 est pauvre, les récepteurs α1 prédominent ; chez les enfants cyanosés, la concentration des récepteurs β2 est également diminuée [10]. En cas de stress important, la contractilité myocardique et le tonus vasculaire périphérique dépendent donc largement d’un apport exogène de catécholamines par les surrénales. La baisse de récepteurs β explique la meilleure efficacité de l’adrénaline (effet α1) et de la milrinone (voie indépendante des récepteurs β) par rapport à la dopamine ou la dobutamine. Par contre, l’innervation parasympathique est normale, d’où la prédominance vagale chez le nouveau-né. L’immaturité du système réticulo-sarcoplasmique comme source de Ca2+ libre pour la contraction myocardique fait que le petit enfant dépend du transport membranaire de Ca2+ pour activer la tropomyosine; il développe donc une force contractile moindre et une relaxation ralentie, et dépend davantage d’un apport extérieur de Ca2+ en cas de stress hémodynamique [2]. Le myocarde infantile est donc très sensible aux interférences avec le métabolisme calcique. De ce fait, les bloqueurs calciques sont contre-indiqués pendant la première année de vie, et les solutions de cardioplégie sont préférentiellement hypocalcémiques [1]. Le coeur du nouveau-né dépend largement de la glycolyse et du lactate, mais très peu de l'oxydation des acides gras, comme source d'énergie. Cette relative capacité à fonctionner par glycolyse anaérobe le rend plus résistant à l'ischémie.
La compliance des cavités cardiaques est faible pendant les premiers mois de vie, et la similarité des ventricules à la naissance accentue leur interdépendance. Ainsi, une défaillance de l'un des ventricules accompagnée d'une augmentation de sa pression télédiastolique (Ptd) provoque un déplacement du septum avec gêne au remplissage de l'autre cavité: la défaillance d'un ventricule aboutit rapidement à une insuffisance congestive bi-ventriculaire. La compliance réduite des ventricules les rend extrêmement sensibles aux variations de précharge: de petites augmentations de volume aboutissent rapidement à une forte élévation des pressions de remplissage. La forme de la courbe de Frank-Starling est différente de celle de l'adulte: la pente de la partie ascendante est très raide, ce qui signifie que le volume systolique est fortement dépendant de la précharge. Mais la courbe atteint très rapidement son plateau (vers 5-8 mm Hg), à partir duquel une augmentation de précharge ne se traduit plus par une augmentation du volume systolique mais seulement par une élévation des pressions de remplissage (Figure 14.7) [2,11].
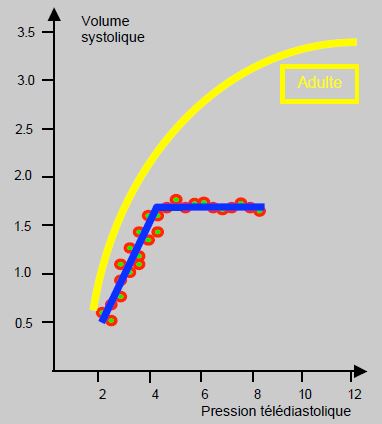
Figure 14.7 : Courbe de Frank-Starling du nouveau-né (en bleu) comparée à celle de l’adulte (en jaune). A remplissage normal, le ventricule est au plateau de la courbe ; les variations de remplissage (Ptd, pression télédiastolique en mmHg) ne modifient pas le volume systolique (VS, en mL/kg) [11].
Le débit ne peut continuer à augmenter avec l'accroissement de la précharge que si la postcharge baisse. Les augmentations de la postcharge sont très mal tolérées; elles provoquent un aplatissement précoce de la courbe de Starling, dont l'effet ressemble à celui d'un agent inotrope négatif. Le débit cardiaque dépend essentiellement de la fréquence car le volume systolique est relativement fixe et le coeur néonatal fonctionne à 95% de sa performance maximale.
Organes et systèmes
Les poumons n'arrivent à maturité complète que vers l'âge de 8 ans. Dans l'enfance, ils sont très sensibles à la réaction inflammatoire systémique (SIRS) et aux lésions d'ischémie-reperfusion, toutes deux caractéristiques de la CEC. Par rapport à ceux de l'adulte, ils sont davantage sujets à une fuite liquidienne interstitielle (capillary leak syndrom) liée à l'hémodilution et aux variations de flux pulmonaire. L'exacerbation de l'hypertension pulmonaire est fréquente chez les petits qui souffrent d'un flux pulmonaire excessif (shunt G-D, truncus arteriosus, etc) [5].
Il faut attendre l'âge de 2 ans pour que les reins développent des capacités excrétrices normales. Jusque-là, les mécanismes de concentration et de dilution ne sont pas entièrement fonctionnels. La CEC est donc caractérisée par une tendance à accumuler davantage de liquide chez les tout-petits qu'à partir de 2-3 ans. L'insuffisance rénale postopératoire est également plus fréquente après CEC: 31%, 14% et 7% des enfants de moins d'un an développent une néphropathie aiguë de degré I, II et III respectivement [3]. Une balance liquidienne voisine de zéro en fin d'opération évite la surcharge de reins hypofonctionnels; on y parvient en recourant à une ultrafiltration conventionnelle per-CEC puis à une ultrafiltration modifiée en fin d'intervention [12]. Les diruétiques (furosémide 1-2 mg/kg, acide éthacrinique 1 mg/kg) sont utilisés en postopératoire [9].
La cascade coagulatoire n'est pas pleinement développée avant un an. La synthèse hépatique des facteurs dépendants de la vitamine K est réduite et les anomalies de la coagulation sont fréquentes (PT et aPTT prolongés, basses concentrations de facteur von Willebrand, de fibrinogène, de facteur V et de facteur VIII). En outre, la concentrations de ces facteurs et celle des plaquettes est diminuée de 50-70% par la CEC [7].
La régulation de la glycémie est faible et le risque d'hypoglycémie est toujours présent, parce que les réserves de glycogène et la synthèse hépatique sont réduites. Chez les nourrissons, les séquelles neurologiques ne sont pas liées à l'hyperglycémie mais bien plutôt au risque permanent d'hypoglycémie [4]. Les régimes de maintien rigoureux de la normoglycémie propres à l'adulte ne sont pas applicables aux petits enfants [6].
| Physiologie du nouveau-né |
|
Le cœur néonatal est peu compliant et peu performant, n'a que peu de réserve fonctionnelle et ne tolère pas les surcharges de volume ou de pression. Seule la fréquence lui permet de varier son débit.
Le risque d'hypoglycémie est plus important que celui d'hyperglycémie. Les poumons, les reins et le foie n'atteignent leur maturité fonctionnelle qu'au-delà de deux ans. L'activité de la coagulation est réduite pendant la première année.
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- ALLEN BS, BARTH MJ, ILBAWI MN. Pediatric myocardial protection: an overview. Semin Thorac Cardiovasc Surg 2001; 13:56-72
- ANDERSON PAW. Immature myocardium. In: MOLLER JH, NEAL WA (eds). Fetal and Infant cardiac disease. Norwalk, CT:Appleton & Lange, 1990, 35-71.
- BLINDER JJ, GOLDSTEIN SL, LEE VV; et al. Congenital heart surgery in infants: effects of acute kidney injury on outcomes. J Thorac Cardiovasc Surg 2012; 143:368-74
- DE FERRANTI S, GAUVREAU K, HICKEY PR, et al. Intraoperative hyperglycemia during infant cardiac surgery is not associated with adverse neurodevelopmental outcomes at 1, 4, and 8 years. Anesthesiology 2004; 100:1345-52
- DÖNMEZ A, YURDAKÖK O. Cardiopulmonary bypass in infants. J Cardiothorac Vasc Anesth 2014; 28:778-88
- HIRSCH JC, JACOBS ML, ANDROPOULOS D, et al. Protecting the infant brain during cardiac surgery: a systematic review. Ann Thorac Surg 2012; 94:1365-73
- KERN FH, MORANA NJ, SEARS JJ, et al. Coagulation defects in neonates during cardiopulmonary bypass. Ann Thorac Surg 1992; 54:541-6
- LAKE CL. Neonatal myocardial and circulatory function. In: LAKE CL. Pediatric Cardiac Anesthesia, 2nd edition, Norwalk : Appleton & Lange, 1993, 33-42
- PICCA S, RICCI Z, PICARDO S. Acute kidney injury in infant after cardiopulmonary bypass. Semin Nephrol 2008; 28:470-6
- SUN LS, DU F, QUAGEBEUR JM. Right ventricular infundibular -adrenoreceptor complex in tetralogy of Fallot patients. Pediatr Res 1997; 42:12-6
- THORNBURG KL, MORTON MJ. Filling and arterial pressures as determinants of RV stroke volume in the sheep fetus. Am J Physiol 1983,;144:H656-H663.
- WANG S, PALANZO D, ÜNDAR A. Current ultrafiltration techniques before, during and after pediatric cardiopulmonary bypass procedures. Perfusion 2012; 27:438-46
