On réunit sous ce terme deux entités différentes présentant le même comportement hémodynamique mais plusieurs noms dans la littérature médicale.
- La cardiomyopathie obstructive (CMO), ou cardiomyopathie hypertrophique asymétrique, avec prédominance de l’hypertrophie au niveau du septum interventriculaire ; c’est une maladie primaire du myocarde qui conduit à une obstruction musculaire dynamique de la chambre de chasse (HISS; hypertrophic idiopathic subaortic stenosis; HOCM, hypertrophic obstructive cardiomyopathy) (voir Chapitre 13 Cardiomyopathie obstructive).
- L’effet CMO, ou sténose sous-aortique dynamique ; elle survient secondairement en cas d’hypertrophie ventriculaire gauche concentrique et de conditions hémodynamiques particulières.
La CMO est une cardiomyopathie hypertrophique caractérisée par un épaississement asymétrique du septum au niveau de la chambre de chasse du VG (CCVG). Mais elle est accompagnée dans les deux tiers de cas d'une élongation des feuillets mitraux (34 mm au lieu de 23-25 mm pour le feuillet antérieur) et d'un déplacement antérieur des muscles papillaires [6,9]. Associée à la sténose musculaire de la CCVG, la bascule antérieure de la partie distale du feuillet antérieur (SAM, voir ci-dessous) conduit à une subobstruction mésosystolique de la voie de chasse gauche générant un gradient maximal de l'ordre de 50 mmHg.
Pour qu’apparaisse un "effet CMO", quatre conditions doivent être remplies (voir Figures 13.9 et 11.122).
- Hypertrophie ventriculaire gauche de type concentrique, avec un muscle puissant et une chambre de chasse étroite; la FE est ≥ 50%.
- Feuillet mitral antérieur long et souple.
- Diminution exagérée du volume télésystolique du VG, secondaire à une hypovolémie sévère ou à une baisse drastique de la postcharge (vasoplégie, levée de l’obstacle de la sténose aortique après RVA); le VG tend à collaber sur lui-même en télésystole.
- Stimulation sympathique excessive qui augmente la course concentrique de la paroi postérieure en systole et déplace le point de coaptation de la valve mitrale vers l'avant. Elle est due à une administration trop rapide de béta-catécholamines ; elle est amplifiée par une anesthésie trop légère.

Figure 13.9: Schématisation du rapport normal entre la valve mitrale et la chambre de chasse du VG (CCVG). L'angle mitro-aortique (MA, en jaune) est ouvert. Le point de coaptation de la valve mitrale est situé au quart postérieur du diamètre de la valve. La paroi postérieure a moins de course que la paroi antérieure; elle est activée en dernier. La pression intraventriculaire maintient l’occlusion de la mitrale (flèche verte) en appuyant les deux feuillets l'un contre l'autre. Le système est construit pour maintenir le point de coaptation de la mitrale aussi éloigné que possible de la CCVG en systole.

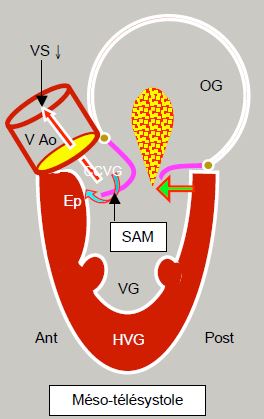
Figure 11.122 : Sténose sous-aortique dynamique dans la cardiomyopathie hypertrophique. L’hypertrophie concentrique et le rétrécissement de la cavité ventriculaire (souvent agravé par l'hypovolémie, par la baisse de postcharge ou par la surstimulation inotrope béta) déplacent la partie postérobasale du VG vers l'avant (flèche verte). En protosystole, le feuillet antérieur et le point de coaptation (Pcoapt) de la valve mitrale sont déplacés vers la chambre de chasse (CCVG), l’angle entre le plan de la valve aortique et celui de la valve mitrale se referme (angle mitro-aortique : pointillé vert). Le point de coaptation est situé entre le bord du feuillet postérieur et le corps du feuillet antérieur, la partie distale de ce dernier flottant à l'intérieur du VG (flèche bleue). En début de systole, la pression intraventriculaire pousse alors le feuillet antérieur dans la CCVG au lieu de le plaquer contre le feuillet postérieur. L’accélération du flux dans la CCVG crée ensuite un effet Venturi qui aspire secondairement le feuillet antérieur de la mitrale (SAM). En mésotélésystole, le feuillet mitral contribue à l’obstruction dynamique de la CCVG. Comme la valve mitrale n’est plus occluse, une régurgitation mitrale (IM) apparaît dans la deuxième moitié de la systole. Ep : éperon septal hypertrophié. HVG: hypertrophie ventriculaire gauche. SAM : systolic anterior motion. VAo: valve aortique.
Un certain nombre de facteurs préopératoires sont des marqueurs de risque pour le SAM (Figure 11.49) [10].
- FE > 60% et dimension réduite de la cavité ventriculaire gauche;
- Hauteur du feuillet postérieur > 15 mm;
- Angle aorto-mitral diminué (< 140°);
- Distance entre le septum interventriculaire et le point de coaptation mitral (C-sept) diminué (< 2.5 cm);
- Déplacement antérieur du muscle papillaire antéro-latéral.

Figure 11.49 : Eléments prédicteurs de bascule du feuillet antérieur dans la chambre de chasse en postopératoire (SAM systolic anterior motion). a : rapport hauteur du feuillet antérieur / hauteur du feuillet postérieur < 1.3. b : distance entre le point de coaptation et le septum < 2.6 cm. c : hauteur du feuillet postérieur déployé en diastole > 1.5 cm. d : angle mitro-aortique refermé (< 140°) [8].
Lorsque la cavité ventriculaire gauche devient très petite, la paroi postéro-basale du VG est déplacée antérieurement et la zone de coaptation mitrale se rapproche de la zone d’éjection. En effet, la zone postérieure de l’anneau mitral est fine et souple, alors que sa partie antérieure est fixée au trigone fibreux, qui est le centre de gravité mécanique du cœur sur lequel sont ancrées les valves mitrale, aortique et tricuspide. C’est donc la zone postérieure qui va se déplacer vers l’avant si le VG se rétrécit excessivement. La diminution de taille de la cavité ventriculaire se traduit donc par un déplacement antérieur des structures postérieures. Ce mouvement a plusieurs effets en systole (voir ci-dessus Figure 11.122) [4].
- Fermeture de l'angle mitro-aortique, normalement > 150°;
- Déplacement antérieur de la zone de coaptation mitrale;
- Coaptation mitrale entre l’extrémité distale du feuillet postérieur et le corps du feuillet antérieur et non plus bord-à-bord;
- Partie du feuillet antérieur distale au point de coaptation flottant à l’intérieur de la cavité du VG en protosystole;
- Augmentation de la course des cordages du pilier postérieur permettant davantage de déplacement antérieur des feuillets.
En systole, la pression intra-ventriculaire va pousser la partie distale du feuillet antérieur vers l’avant en direction de la CCVG, où l’éjection a commencé. Comme la Vmax s’élève dans la CCVG, la partie distale de ce feuillet peut y être aspirée par effet Venturi et induire un phénomène appelé systolic anterior motion (SAM) : le feuillet antérieur se coude et vient occlure partiellement la CCVG (Figure 11.123). C’est l’effet CMO, par analogie au mécanisme de la cardiomyopathie obstructive (Vidéos) [5]. Il est parfaitement visible sur les vues ETO de la CCVG (5-cavités 0-30° et long-axe 120-140°).
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue long-axe 140°); cet effet CMO est lié à un épisode d'hypovolémie chez un patient souffrant d'une hypertrophie ventriculaire gauche concentrique.
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue long-axe 130°); cet effet CMO survient après un remplacement aortique pour sténose avec une bioprothèse.
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue 4-cavités 0°); cet effet CMO survient après un remplacement aortique pour sténose.
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue long-axe 140°); cet effet CMO est lié à un épisode d'hypovolémie chez un patient souffrant d'une hypertrophie ventriculaire gauche concentrique.
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue long-axe 130°); cet effet CMO survient après un remplacement aortique pour sténose avec une bioprothèse.
Vidéo: Déplacement systolique antérieur (SAM) du feuillet mitral antérieur dans la chambre de chasse en mésosystole (vue 4-cavités 0°); cet effet CMO survient après un remplacement aortique pour sténose.
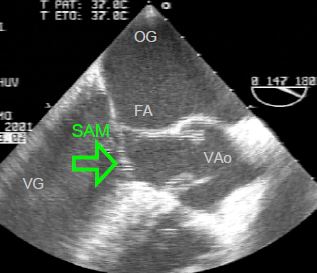
Figure 11.123 : Sténose sous-aortique dynamique. Image ETO de l’aspiration du feuillet antérieur (SAM, systolic anterior motion) dans la CCVG (vue long-axe 140°).
Le SAM crée une accélération du flux > 2.5 m/s et un gradient de pression important au sein de la CCVG; le débit systolique baisse brusquement [7]. Cette chute mésosystolique du débit se traduit par un collapsus prématuré des feuillets de la valve aortique, car le volume éjecté est soudain insuffisant pour la maintenir ouverte (Figure 11.124). Ce signe, bien visible en mode TM à travers la valve aortique, est pathognomonique de l'effet CMO. Tant qu'il est présent, le phénomène est actif et nécessite un traitement agressif; seule sa disparition signe le succès thérapeutique. Toutefois, cet élément n’est pas visible lorsque la valve est remplacée par une prothèse. On ne voit alors que la modification de silhouette du flux aortique qui est déformé "en dague". Cette chute mésosystolique du débit aortique est souvent visible sur la courbe artérielle qui affiche la même encoche dans la partie ascendante du tracé (Figure 11.125).
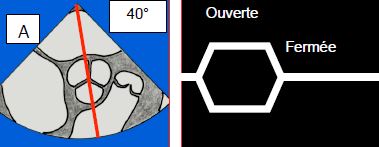

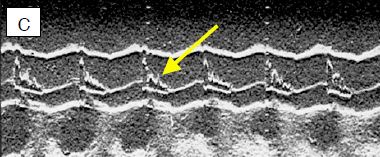
Figure 11.124: Vues échocardiographiques en mode TM (temps-mouvement) de la valve aortique. La chute du volume systolique conduit à un collapsus des feuillets de la valve aortique, parce que la baisse du volume ne la maintient plus ouverte. A: axe TM à travers une vue court-axe de la valve aortique; schéma de l'ouverture et de la fermeture de la valve aortique. B: l'image normale est quasi-quadrangulaire, la valve est ouverte pendant toute la systole. C: l'image dans une CMO montre un collapsus des feuillets (flèche) en méso-systole. Cet aspect est pathognomonique de la subocclusion de la CCVG.


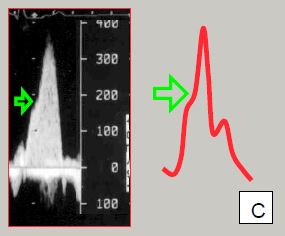
Figure 11.125 : Sténose sous-aortique dynamique après remplacement valvulaire aortique (RVA). A : avant le RVA, la vélocité maximale (Vmax) est élevée à travers la sténose aortique (> 4 m/s), mais non dans la chambre de chasse (CCVG) (< 1 m/s), car elle est freinée avant l’obstacle de la valve ; le VG et le septum interventriculaire sont hypertrophiques (Sep HVG). B : après RVA, l’obstacle est levé, la Vmax à travers la valve baisse ; mais la CCVG reste hypertrophique et peut maintenant se rétrécir excessivement au cours de la systole en cas de stimulation sympathique puisqu’il n’y a plus d’obstacle pour y maintenir une pression élevée. La Vmax exagérée dans la CCVG aspire le feuillet antérieur (FA) de la valve mitrale qui obstrue partiellement la CCVG (SAM : systolic anterior motion). Cette sténose dynamique représente un gradient de pression (ΔP) significatif qui s’additionne au ΔP propre de la prothèse lorsqu’on mesure le gradient à l’écho Doppler (flèche jaune). C : la subocclusion dynamique de la CCVG survient dans la deuxième partie de la systole et se manifeste par une chute du débit mais une accélération du flux ; ce phénomène s’exprime par une encoche (flèche verte) sur la pente ascentionnelle du flux, souvent visible sur la courbe de la pression artérielle (déformation en dague).
L'aspiration du feuillet antérieur dans la CCVG a pour effet secondaire de rouvrir la valve mitrale en mésosystole et de provoquer une insuffisance méso-télésystolique. Cette IM fait que la PAPO lue sur le cathéter pulmonaire est trompeusement élevée malgré l’hypovolémie ventriculaire.
Après un RVA, les conditions pour un effet CMO sont fréquemment remplies: il existe une HVG concentrique, la postcharge a baissé parce que la sténose est levée, l’hypovolémie est banale en sortant de CEC, et l’administration de catécholamines force la contraction de la paroi postérieure, le rétrécissement de la CCVG et la vélocité d’éjection du sang. Le phénomène de SAM survient en sortant de CEC dans 14% des RVA pour sténose [1]. Il est confirmé par l’échocardiographie: la cavité ventriculaire est de petites dimensions, la Vmax dans la chambre de chasse est supérieure à 2.5 m/sec, le gradient est > 30 mmHg dans les cas modérés et > 50 mmHg dans les cas sévères, le feuillet mitral se rabat dans la chambre de chasse (SAM), une insuffisance mitrale apparaît en deuxième moitié de systole [2,3]. Il est essentiel de calculer le gradient trans-valvulaire avec l’équation de Bernoulli prenant en compte la vélocité dans la chambre de chasse : ΔP = 4 • (Vtotale2 – VCCVG2), car celle-ci (VCCVG) est largement au dessus de 1.5 m/s ; à elle seule, elle induit un ΔPmax > 25 mmHg qu’il faut soustraire du gradient total de la voie d’éjection (Vtotale) pour mesurer le gradient propre à la prothèse aortique (voir Figure 11.121). Le rapport entre la vélocité dans la CCVG et celle à travers la valve (VCCVG / VVAo) est utile pour apprécier le degré d’accélération généré par la prothèse; normalement, ce rapport doit être > 0.5 [12].
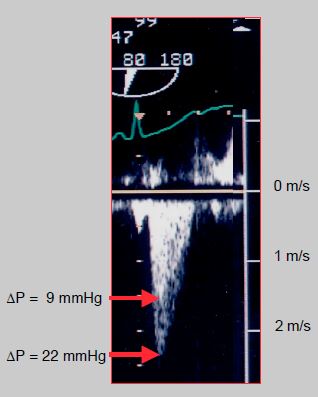
Figure 11.121 : Calcul du gradient de pression après RVA. Au Doppler continu, on dispose d’une double enveloppe pour mesurer la Vmax dans la CCVG et dans l’ensemble CCVG + prothèse. Si l’on utilise l’équation simplifiée de Bernoulli (ΔP = 4 • Vmax2), on trouve un gradient de 22 mmHg. Si l’on utilise l’équation en tenant compte de la Vmax dans la CCVG, soit ΔP = 4 • (V22 – V12), le gradient à travers la prothèse n’est que de 10 mmHg. Dans le cas d’une bioprothèse sans monture, cette différence a un impact chirurgical direct, car 22 mmHg est un gradient excessif pour ce type de valve et peut conduire à un retour en CEC qui n’est en réalité pas justifié.
Le phénomène de SAM apparaît également en sortant de CEC dans 7% des plasties mitrales, à cause d'un déséquilibre entre la taille restrictive de l'anneau mitral implanté et la longueur excessive des feuillets mitraux, en particulier celle du feuillet postérieur (> 15 mm) [11]. Dans ces conditions, le point de coaptation de la mitrale est ramené trop antérieurement. La thérapeutique est d'abord médicale, ce qui est suffisant dans environ 95% des cas. Mais lorsque le gradient dans la CCVG est > 50 mmHg et lorsque le traitement conservateur est un échec, un retour en pompe s'impose pour raccourcir le feuillet postérieur et éventuellement changer la taille de l'anneau pour un plus grand.
Cliniquement, l'effet CMO se caractérise par une hypotension artérielle et un bas débit cardiaque qui ne réagissent pas aux catécholamines; au contraire, ces dernières tendent à aggraver la situation. La thérapeutique consiste en plusieurs points [3].
- Diminution de contractilité: arrêt des catécholamines à effet β;
- Augmentation du volume ventriculaire: perfusion de cristalloïdes ou de collloïdes;
- Augmentation de la postcharge : vasoconstricteur artériel à effet alpha pur (phényléphrine, nor-adrénaline);
- Approfondissement de l’anesthésie;
- Si ces mesures sont insuffisantes: esmolol (bolus répétés de 10 mg), prescription de β-bloqueur dans le postopératoire;
- En résumé, en cas de CMO le patient doit être maintenu plein, mou et fermé.
Si l’effet persiste malgré un traitement maximal, le pas suivant consiste en un traitement invasif.
- Post-RVA: résection chirurgicale dans la musculature de la CCVG (myectomie), notamment au niveau de l’éperon septal. Cette myectomie doit être précautionneuse, car une profondeur excessive de l'excision peut conduire à une communication interventriculaire qui doit être réparée sur-le-champ.
- Post-plastie mitrale: réfection de la plastie du feuillet postérieur pour en réduire la longueur, éventuellement changement d'anneau pour une taille supérieure; le but est de ramener le point de coaptation de la valve plus en arrière et de l'éloigner ainsi de la CCVG [11].
- Cardiomyopathie obstructive; embolisation alcoolique de la première artère septale pour provoquer une nécrose partielle du muscle, myectomie septale chirurgicale, plicature de raccourcissement du feuillet antérieur, repositionnement du muscle papillaire antérieur [9].
L'anesthésiste-échocardiographeur joue un rôle capital pour le diagnostic et le traitement de l'effet CMO.
- Diagnostic du SAM:
- Bascule de la partie distale du feuillet mitral antérieur dans la CCVG en méso-systole (vues mi-oesophagiennes 4-cavités 0° et long-axe 120°).
- Accélération du flux dans la CCVG (aliasing au flux couleur, Vmax > 2.5 m/s, ΔP > 25 mmHg); silhouette "en dague" du flux spectral transaortique (vues transgastriques).
- Collapsus mésosystolique des cuspides aortiques (mode TM de la valve aortique en court-axe 40°).
- Insuffisance mitrale méso-télé-systolique (durée brève) dirigée postéro-latéralement.
- Mesures de la longueur des feuillets mitraux.
- Mesure de l'épaisseur du septum au niveau de la CCVG et de l'éperon septal.
- Détermination des marqueurs du risque de SAM.
- Recherche de CIV postopératoire.
| Sténose sous-aortique dynamique |
|
La conjonction d'une HVG concentrique, d'un feuillet mitral antérieur long et souple, d'une hypovolémie, d'une baisse de postcharge et d'une sur-stimulation inotrope peuvent conduire à une obstruction dynamique de la CCVG identique au mécanisme de la cardiomyopathie obstructive (CMO). Le résultat est une subobstruction mésosystolique de la CCVG par la partie distale du feuillet antérieur (SAM, systolic anterior motion). Le phénomène se caractérise par:
- Vmax > 2.5 m/s dans la CCVG
- Suboclusion de la CCVG par le feuillet antérieur de la valve mitrale (SAM)
- Collapsus mésosystolique des feuillets de la valve aortique (mode TM en court-axe ou long-axe de la valve aortique)
- IM méso-télésystolique
- Déformation en dague du flux aortique et de la courbe artérielle
La conséquence est un épisode d'hypotension et de bas débit aggravé par les catécholamines.
Traitement :
- Réduire les catécholamines β, bolus d’esmolol
- Augmentation de la précharge (perfusions)
- Augmentation de la postcharge (vasoconstricteurs α)
- Si échec : retour en pompe pour myectomie dans la CCVG
Hémodynamique recherchée en cas d’effet CMO
Précharge élevée
Contractilité diminuée (stop catécholamines β, esmolol)
Vasoconstriction systémique
Plein – Mou – Fermé
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- BARTUNEK J, SYS SU, RODRIGUEZ AC, et al. Abnormal systolic intraventricular flow velocities after valve replacement for aortic stenosis. Circulation 1996; 93:712-9
- GERSH BJ, MARON BJ, BONOW RO, et al. 2011 ACCF/AHA Guideline for the diagnosis and treatment of hypertrophic cardiomyopathy: Executive summary. Circulation 2011; 124:2761-96
- HENSLEY N, DIETRICH J, NYHAN D, et al. Hypertrophic cardiomyopathy: a review. Anesth Analg 2015; 120:554-69
- JAIN P, PATEL PA, FABBRO M. Hypertrophic cardiomyopathy and left ventricular outflow tract obstruction: expecting the unexpected. J Cardiothorac Vasc Anesth 2018; 32:467-77
- LEFEBVRE XP, HE S, LEVINE RA, et al. Systolic anterior motion of the mitral valve in hypertrophic cardiomyopathy: an in vitro pulsatile flow study. J Heart Valve Dis 1995; 4:422-38
- LEVINE RA, HAGÉGE AA, JUDGE DP, et al. Mitral valve diasease – morphology and mechanisms. Nat Rev Cardiol 2015; 12:689-710
- LIN CS, CHEN KS, LIN MC, et al. The relationship between systolic anterior motion of the mitral valve and the left ventricular outflow tract Doppler in hypertrophic cardiomyopathy. Am Heart J 1991; 122:1671-6
- MASLOW AD, HAERING JM, LEVINE RA, et al. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease. J Am Coll Cardiol 1999; 34:2096-104
- SHERRID MV, BALARAM S, KIM B, et al. The mitral valve in obstructuve hypertrophic cardiomyopathy. A test in context. J Am Coll Cardiol 2016; 67:1846-58
- TAVLASOGLU M, DURUKAN AB, GURBUZ HA. Is a "narrow aorto-mitral angle and associated factors" associated with development of systolic anterior motion? J Thorac Cardiovasc Surg 2013; 145:617
- VARGHESE R, ANYANWU AC, ITAGAKI S, et al. Management of systolic anterior motion after mitral valve repair: an algorithm. J Thorac Cardiovasc Surg 2012; 143:S2-7
- ZOGHBI WA, CHAMBERS JB, DUMESNIL JG, et al. Recommendations for evaluation of prosthetic valves with echocardiography and Doppler ultrasound. J Am Soc Echocradiogr 2009; 22:975-1014
