Embryologie
Les principales étapes du développement embryologique cardiaque ont lieu entre la 3ème et la 8ème semaine post-conceptionnelle. Le tube cardiaque primitif est une structure mésodermique qui commence à battre le 22ème jour. Il comprend plusieurs parties (Figure 14.1) [7].
- Le bulbe cardiaque, dont la partie distale (truncus) formera les chambres de chasse des ventricules et la partie proximale (conus) le ventricule droit;
- Le ventricule primitif constituera essentiellement le futur ventricule gauche;
- L’oreillette primitive donnera les deux oreillettes droite et gauche;
- La corne droite du sinus venosus participera à l’OD et la corne gauche deviendra le sinus coronaire.
Figure 14.1 : Embryologie du cœur. A : tube cardiaque à 3 semaines ; le truncus et le conus forment ensemble le bulbus cordis. B : enroulement du tube sur lui-même par une rotation amenant le VD autour du VG et l’oreillette primitive vers le haut et vers l’arrière. Le conus va former la partie non-trabéculée du VD. C : à 28 jours, l’oreillette est en arrière et se divise en deux, le VG est bien identifié. Le VD est constitué de 2 parties: le conus sera la partie non-trabéculée, la partie trabéculée est issue du ventricule primitif; le truncus formera les chambres de chasse [6].
Ce tube va se plier sur lui-même de telle sorte que le conus se retrouve à côté et en avant du ventricule primitif, et les oreillettes en arrière des ventricles. Ce mouvement explique la manière dont le VD est enroulé en croissant autour du VG (Figure 14.2).
Figure 14.2 : A et B : le VD a une allure de croissant enroulé autour du VG (gris et pointillé). Il est constitué d’une chambre d’admission, d’un corps (avec l’apex) et d’un infundibulum avec la chambre de chasse (CCVD) qui a une forme tubulaire. VT : valve tricuspide. AP : artère pulmonaire. C : La crista supraventricularis (CS) sépare la zone trabéculée (admission, apex et corps du ventricule) de la chambre de chasse. En vue ETO transgastrique, on voit les parois inférieure, latérale et antérieure du VD. Cette forme complexe du VD rend difficile la mesure de son volume et de sa fraction d'éjection.
La septation des cavités s’opère par fusion des bourgeons supérieur et inférieur des septum interauriculaire et intervenriculaire; elle est terminée à la 6ème semaine. La septation du truncus se fait par une membrane qui se construit en spirale, de sorte que l’aorte et l’artère pulmonaire s’enroulent l’une autour de l’autre lorsqu’elles sont complètement séparées (8ème semaine). Les valves cardiaques sont achevées plus tardivement: à la 10ème semaine pour les valves ventriculo-artérielles et à la 12ème semaine pour les valves auriculo-ventriculaires [6]. Le cœur est entièrement constitué au 50ème jour.
Circulation fœtale
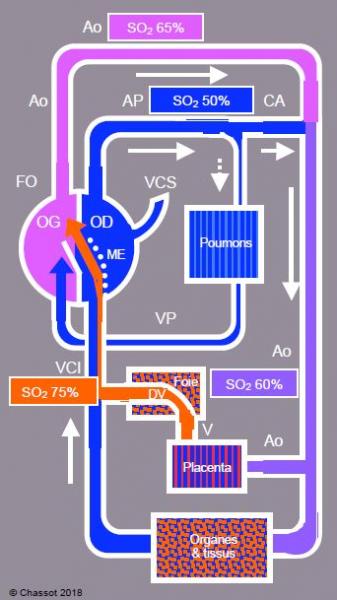
In utero, l’oxygénation du sang a lieu dans le placenta et non dans les poumons. Le sang saturé en O2 (PO2 35 mmHg, SO2 75%) revient au cœur par la veine ombilicale et le foie, où il court-circuite le système porte par le ductus venosus (DV) ou canal d’Arantius, qui l’achemine directement vers la veine cave inférieure (VCI) (Figure 14.3).
In utero, l’oxygénation du sang a lieu dans le placenta et non dans les poumons. Le sang saturé en O2 (PO2 35 mmHg, SO2 75%) revient au cœur par la veine ombilicale et le foie, où il court-circuite le système porte par le ductus venosus (DV) ou canal d’Arantius, qui l’achemine directement vers la veine cave inférieure (VCI) (Figure 14.3).
Figure 14.3 : Schéma de la circulation fœtale. Le sang saturé en O2 (PaO2 35 mmHg, SO2 75%) revient au cœur par la veine ombilicale et le foie, où il est shunté directement vers la veine cave inférieure (VCI) par le ductus venosus (DV). Entré dans l’oreillette droite (OD), il est dirigé majoritairement vers le foramen ovale (FO) par la membrane d’Eustache (ME), d’où il gagne l’oreillette gauche (OG). Le sang très désaturé (SO2 40%) de la veine cave supérieure (VCS) reste dans le cœur droit et gagne l’artère pulmonaire (AP, SO2 50%). Le sang de l’AP est dirigé vers l’aorte descendante par le canal artériel (CA), parce que les résistances vasculaires pulmonaires sont très élevées. Dans le schéma du cœur, les ventricules ne sont pas représentés.
Entré dans l’oreillette droite (OD), il est dirigé en majeure partie vers le foramen ovale (FO) par la membrane d’Eustache, d’où il gagne l’oreillette gauche (OG). Le sang très désaturé (SO2 40%) de la veine cave supérieure (VCS) reste dans le cœur droit et gagne l’artère pulmonaire (AP, SO2 50%). Le sang de l’AP est dirigé vers l’aorte descendante par le canal artériel (CA), parce que les résistances vasculaires pulmonaires sont très élevées ; le flux à travers les poumons ne représente que le 7% du débit cardiaque. Ainsi, le sang riche en oxygène et en glucose revenant du placenta perfuse préférentiellement le cerveau, les coronaires et les membres supérieurs (SO2 65%), alors que les organes splanchniques sont alimentés par du sang moins saturé (SO2 55-60%) en provenance du canal artériel [3]. Le VD conribue pour 55% au débit cardiaque total et le VG au 45% [7]. Les deux tiers du flux de l’aorte descendante vont au placenta. La circulation systémique et la circulation pulmonaire fonctionnent en parallèle.
Entré dans l’oreillette droite (OD), il est dirigé en majeure partie vers le foramen ovale (FO) par la membrane d’Eustache, d’où il gagne l’oreillette gauche (OG). Le sang très désaturé (SO2 40%) de la veine cave supérieure (VCS) reste dans le cœur droit et gagne l’artère pulmonaire (AP, SO2 50%). Le sang de l’AP est dirigé vers l’aorte descendante par le canal artériel (CA), parce que les résistances vasculaires pulmonaires sont très élevées ; le flux à travers les poumons ne représente que le 7% du débit cardiaque. Ainsi, le sang riche en oxygène et en glucose revenant du placenta perfuse préférentiellement le cerveau, les coronaires et les membres supérieurs (SO2 65%), alors que les organes splanchniques sont alimentés par du sang moins saturé (SO2 55-60%) en provenance du canal artériel [3]. Le VD conribue pour 55% au débit cardiaque total et le VG au 45% [7]. Les deux tiers du flux de l’aorte descendante vont au placenta. La circulation systémique et la circulation pulmonaire fonctionnent en parallèle.
Circulation transitionnelle
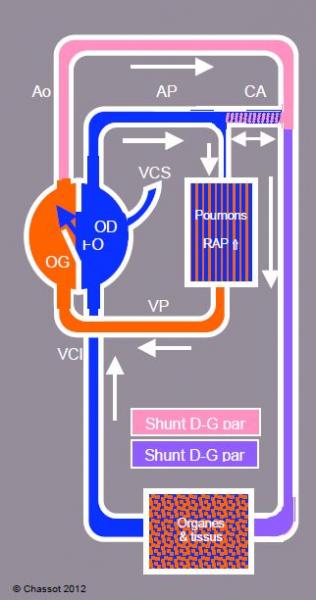
A la naissance, la circulation doit s’adapter à la suppression du circuit placentaire (clampage du cordon) et à l’entrée en fonction des poumons comme oxygénateurs. Les résistances artérielles pulmonaires (RAP) baissent, le canal artériel et le foramen ovale se ferment. Cette période instable dure de quelques heures à plusieurs semaines : c’est la circulation transitionnelle (Figure 14.4), état labile pendant lequel un retour à une circulation de type fœtal survient sous l’effet de l’hypoxie, de l’hypothermie, de l’acidose ou du stress (Tableau 14.2).
Figure 14.4 : Circulation transitionnelle avec ouverture momentanée de shunts droite – gauche par le foramen ovale (FO) et par le canal artériel (CA) suite à une augmentation des résistances artérielles pulmonaires (RAP). L’enfant devient cyanosé. Le sens du flux à travers le canal artériel dépend du rapport de pression entre l’aorte et l’artère pulmonaire ; dans les réactions hypertensives pulmonaires sévères, il est G → D en systole, mais D → G en diastole.

La circulation transitionnelle présente un certain nombre de caractéristiques [5,7].
- L’occlusion fonctionnelle du CA se fait entre 10 et 15 heures de vie, mais sa fermeture anatomique prend 4-6 semaines. Pendant cette période, il persiste un faible flux gauche→droit (G-D) ; une élévation de la PaO2 augmente la vasoconstriction du canal, alors qu’une baisse de la PaO2 le rouvre. Ceci est vrai pour l'enfant né à terme, car le CA immature ne se contracte pas, même en cas d'hyperoxie. La prostaglandine E1 relâche la musculature du canal et le maintient perméable, à PaO2 basse ou élevée ; ce phénomène permet d’assurer une vicariance par le CA depuis l’aorte en cas de bas débit pulmonaire ou depuis l’AP en cas d’interruption de l’arc aortique. L'indométhacine, inhibiteur des prostaglandines, peut induire la fermeture du CA dans la période néonatale chez le prématuré. Le paracétamol (acetaminophen) semble être également prometteur avec moins d'effets indésirables [2]. La présence d'un des facteurs mentionnés dans le Tableau 14.2 peut prolonger sa perméabilité, aboutissant à un shunt dont la direction dépend du rapport des pressions systémiques et pulmonaires: il peut être G-D en cas d'obstruction au flux pulmonaire (atrésie pulmonaire ou tricuspidienne) ou D-G si l'obstruction porte sur le flux aortique (hypoplasie aortique, coarctation).
- Le FO se ferme dès que la pression de l’OG dépasse celle de l’OD dans les premiers jours de vie. Toutefois, l’occlusion anatomique n’est pas constante : le FO reste perméable à l’âge adulte chez environ 25% des adultes [1,8]. Tout ce qui augmente les RAP (Tableau 14.3) peut provoquer un shunt D-G par cet orifice. Même en l'absence d'hypertension pulmonaire, la toux ou la manoeuvre de Valsalva peuvent élever la pression de l'OD suffisamment pour provoquer un shunt D-G et expliquer ainsi la survenue d'embolies paradoxales.
- Les résistances artérielles pulmonaires (RAP) sont élevées in utero, mais baissent rapidement à la naissance ; elles sont à la moitié des valeurs systémiques après 24 heures de vie et diminuent ensuite graduellement pendant 5-6 semaines ; elles atteignent leur valeur adulte vers l’âge de 3 ans (Figure 14.5) [3].

Figure 14.5 : Evolution des résistances artérielles pulmonaires (RAP) après la naissance (en mmHg/mL/min/kg) [d’après réf 2].
- Le lit vasculaire pulmonaire est particulièrement réactif pendant cette période ; une poussée hypertensive pulmonaire (HATP) survient facilement en cas d’hypoxémie, d’hypercarbie, d’acidose ou de bronchospasme. Dans les premiers jours de vie, cela peut conduire à un shunt D-G par le canal artériel ou le foramen ovale (voir Figure 14.4). La chute rapide des RAP pendant les premières heures de vie est due à une vasodilatation active en réponse à l’élévation de la pO2 et à l’expansion des alvéoles nouvellement ventilées. Par contre les transformations des premières années sont liées à des modifications anatomiques (arborisation du lit vasculaire pulmonaire) qui peuvent être ralenties ou supprimées par les facteurs mentionnés dans le Tableau 14.3. Une surcharge de volume et de pression par un shunt G-D freine la baisse des RAP et provoque une augmentation secondaire de la pression artérielle pulmonaire.
- L’artère et la veine ombilicale se ferment peu après la naissance, de même que le ductus venosus.
- La masse des deux ventricules est à peu près égale à la naissance. L’épaisseur du ventricule connecté au réseau pulmonaire à basse résistance (mormalement le VD) diminue rapidement, alors que le ventricule connecté aux RAS s’épaissit.
La période néonatale est caractérisée par des résistances et une réactivité pulmonaires accrues. La musculature vasculaire pulmonaire très développée et la faible arborisation des vaisseaux induisent des poussées d'hypertension pulmonaire en cas de stimulation nociceptive (Tableau 14.3). Les enfants atteints de cardiopathies congénitales accompagnées d’une forte augmentation du débit pulmonaire (shunt G-D) peuvent conserver des artérioles très muscularisées et des résistances pulmonaires élevées en permanence. En outre, ils sont susceptibles de développer des crises vasospastiques pulmonaires paroxystiques, pouvant aller jusqu'à l'inversion du rapport des pressions pulmonaires et systémiques. Ces crises induisent une défaillance aiguë du ventricule droit (POD élevée) et une insuffisance systémique par petit débit (POG basse). Elles peuvent être déclenchées par tous les phénomènes qui augmentent les RAP et peuvent survenir sans signes annonciateurs. Elles sont particulièrement fréquentes après les interventions en CEC, car de nombreux facteurs humoraux, endothéliaux et mécaniques liés à cette dernière contribuent à l'élévation des résistances pulmonaires. Une anamnèse de modifications soudaines de la PAP est un bon signe annonciateur d'insuffisance droite postopératoire.
Circulation adulte
Circulation adulte
La circulation adulte assure une séparation complète des sangs artériel saturé et veineux désaturé, avec une circulation systémique et une circulation pulmonaire en série (Figure 14.6).


Figure 14.6 : La circulation adulte assure une séparation complète des sangs artériel saturé et veineux désaturé, avec une circulation systémique et une circulation pulmonaire en série.
| Circulation fœtale et transitionnelle |
|
Circulation fœtale : sang oxygéné du placenta (SO2 75%) → v ombilicale → foie (ductus venosus) → VCI → OD → foramen ovale → OG → VG → coronaires, cerveau, membres supérieurs. Sang désaturé de VCS (SO2 40%) → VD → AP → canal artériel → viscères, membres inférieurs.
Circulation transitionnelle : période instable pendant laquelle se ferment le ductus venosus (1-2 heures), le canal artériel (< 24 heures) et le foramen ovale (25% reste perméable). L’hypoxie, l’acidose, l’hypothermie ou le stress augmentent la PAP et induisent un retour à la circulation fœtale.
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- AGOUSTIDES JG, WEISS SJ, WEINER J, et al. Diagnosis of patent foramen ovale with multiplane transesophageal echocardiography in adult cardiac surgical patients. J Cardiothorac Vasc Anesth 2004; 18:725-30
- BARDANZELLU F, NERONI P, DESSI A, et al. Paracetamol in patent ductus arteriosus treatment: efficacious and safe? Biomed Res Int 2017; 2017:143803
- CLARKE WR. Anesthetic care of the infant with abnormal transitional circulation. Problems in Anesthesia 1988; 2:477-89
- DUPUIS C, KACHANER J, FREEDOM R, PAYOT M, DAVIGNON A. Cardiologie pédiatrique, 2ème édition. Paris: Flammarion, 1991, 115-123
- FINEMAN JR, SOIFER SJ, HEYMANN MA. Regulation of pulmonary vascular tone in the perinatal period. Annu Rev Physiol 1995; 57:115-34
- KLOESEL B, DINARDO JA, BODY SC. Cardiac embryology and molecular mechanisms of congenital heart disease – A primer for anesthesiologists. Anesth Analg 2016; 123:551-69
- KUSSMAN BD, HOLZMAN RS. Cardiac embryology : Understanding congenital heart disease for the noncardiac anesthesiologist. Sem Cardiothorac Vasc Anesth 2001 ; 5 : 2-20
- SCHNEIDER B, ZIENKIEWICZ T, JANSEN V, et al. Diagnosis of patent foramen ovale by transesophageal echocardiography and correlation with autopsy findings. Am J Cardiol 1996; 77:1202-9