Echocardiographie bidimensionnelle
L’échocardiographie transthoracique établit le diagnostic et fourni la plupart des renseignements nécessaires à l’intervention, mais la voie transoesophagienne (ETO) apporte incontestablement une meilleure définition des lésions et de l’hémodynamique mitrale. Cet examen va fournir les données les plus importantes au sujet de la sténose mitrale (SM) (Vidéo et Figure 11.87) [4].
Vidéo: vue 4-cavités dans un cas de sténose mitrale serrée; le VG est petit alors que l'OG est très agrandie, les feuillets mitraux sont retenus en diastole, l'ouverture est minime; le corps des feuillets est souple alors que leurs extrémités sont très remaniées.



Figure 11.87 : Sténose mitrale (SM) lors de RAA (images ETO). A : vue 4-cavités ; l’OG est gigantesque, le VG est petit ; la fusion commissurale retient les feuillets en diastole et l’ouverture (flèche) est minime. B : fusion commissurale très serrée des deux feuillets. C : le corps du feuillet antérieur, resté souple dans le RAA, bombe dans l’OG en systole. D : le corps du feuillet antérieur bombe dans le VG en diastole (déformation en canne de hockey).
- Images bidimensionnelles classiques:
- Dilatation de l’OG, présence de contraste spontané (bas débit) et de thrombus dans l’AAG ou dans le corps de l’OG (plus rare) (Vidéo).
Vidéo: Vue de l'appendice auriculaire gauche, avec présence de contraste spontané apparaissant comme des volutes de fumée.
- Dimension réduite du VG, fonction conservée.
- RAA: fusion commissurale des deux feuillets, mouvements limités des feuillets, déformation en canne de hockey (hockey-stick) du feuillet antérieur en diastole, épaississement et rétraction de l’appareil sous-valvulaire.
- Dégénéresence calcifiante: calcification massive de l'anneau et de la base des feuillets, coulées calciques dans le corps des feuillets mais extrémités libres.
- Dilatation et dysfonction du VD, HVD, taille de l’OD, insuffisance tricuspidienne.
- Dilatation de l’OG, présence de contraste spontané (bas débit) et de thrombus dans l’AAG ou dans le corps de l’OG (plus rare) (Vidéo).
- Images Doppler couleur: accélération du flux diastolique à travers la valve mitrale : zone d’accélération concentrique du côté auriculaire (PISA : proximal isovelocity surface area), flux rapide à travers la valve (Vmax 1.5 – 2.5 m/s), turbulences côté ventriculaire (Vidéo) (Figure 11.92).
Vidéo: Sténose mitrale serrée avec flux diastolique accéléré et tourbillonnaire, précédé d'une zone d'accélération concentrique côté auriculaire; la sténose est accompagnée d'une régurgitation systolique (maladie mitrale).
- Présence d’une éventuelle IM associée.
- Recherche d’une maladie aortique (atteinte rhumatismale polyvalvulaire) et d’une insuffisance tricuspidienne (en général due à la surcharge droite et à l’hypertension pulmonaire).
- Fonction du VG: elle est souvent altérée par l'inflammation (myocardite du RAA) ou par l'âge et les comorbidités (dégénéresence calcifiante). L'insuffisance diastolique est responsable d'une élévation de la PtdVG et de la POG indissociable des effets de la sténose mitrale.

Figure 11.92 : Flux Doppler couleur dans la sténose mitrale. On voit une zone d’accélération concentrique diastolique sur le versant auriculaire de la valve (PISA proximal isovelocity surface area) et un flux tourbillonnaire entre les feuillets. Le cône formé par les feuillets fusionnés est défini par son angle α.
Plusieurs indices ont été imaginés pour évaluer les possibilités et les risques de la commissurotomie percutanée au ballon, qui est l'intervention de premier choix [7]. Le plus connu est le score de Wilkins attribue un certain nombre de points sur une échelle de 1 à 4 à quatre données échocardiographiques: mobilité des feuillets, épaississement de la valve, degré de calcification et remaniement de l'appareil sous-valvulaire. La situation est considérée comme favorable pour une commissurotomie au ballon si le nombre de points est ≤ 8 sur un maximum possible de 16 points [6].
Echocardiographie 3D
Les mesures bidimensionnelles supposent que la surface d'ouverture de la sténose est parallèle au plan de coupe et que son dessin correspond à la zone la plus étroite. Or la valve est déformée en cône plongeant dans le VG et rien ne prouve que la section passe par l'endroit le plus rétréci. Avec l'imagerie 3D, en revanche, il est possible de réaliser une planimétrie à l'endroit le plus ténu du passage diastolique, quel que soit sa forme et son orientation (Vidéo et Figure 11.88). La planimétrie 3D fournit les données les plus fiables de la surface mitrale [3,7].
Vidéo: vue en 3D depuis le VG, la sténose mitrale apparaît comme un cône plongeant dans le ventricule; son ouverture diastolique n'est qu'une fente.
Vidéo: vue en 3D depuis le VG, la sténose mitrale apparaît comme un cône plongeant dans le ventricule; son ouverture diastolique n'est qu'une fente.

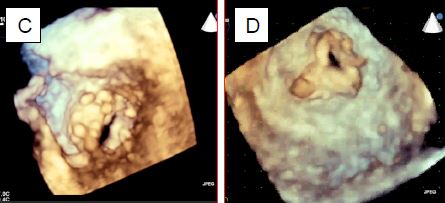
Figure 11.88 : Images échocardiographiques 3D de sténose mitrale. A : vue depuis l’OG ; l’ouverture est au fond d’un cône à cause de la fusion des commissures (flèche simple), en dessous du plan de l’anneau (double flèche). B: vue auriculaire d'une sténose mitrale; l'ouverture est une fente limitée par les fusions commissurales. C : vue depuis le VG ; la valve est déformée en cône, l’ouverture n’est plus qu’une fente. D: vue depuis le VG de la sténose secondaire d'une bioprothèse mitrale dont on reconnaît la forme triangulaire.
Gradient de pression
Comme la valve est située en face du transducteur ETO, l’axe du Doppler est bien aligné avec le flux mitral et permet de calculer de manière précise les gradients de pression transvalvulaires en diastole (Figure 11.93) [2].
- La vélocité maximale du flux (Vmax) permet de calculer le gradient maximal par l’équation de Bernouilli simplifiée ΔP = 4 (Vmax)2 ; il est ≥ 20 mmHg dans la sténose serrée.
- Le dessin du pourtour du flux mitral au Doppler spectral permet de calculer le gradient moyen (ΔPmoy), qui est la moyenne des gradients instantanés enregistrés pendant la durée du flux ; il est de 5-10 mmHg dans la sténose modérée et ≥ 10 mmHg dans la sténose serrée. Comme il est moins dépendant des conditions hémodynamiques que le ΔPmax, le ΔPmoy est un critère plus fiable du degré de sténose.
- Les gradients de pression varient avec la tachycardie (diastole courte) et le débit cardiaque (flux diastolique bas ou élevé): un bas débit induit une sous-estimation du degré de sténose; il en est de même de la dysfonction diastolique. En cas de FA, il est conseillé de faire la moyenne de 3-5 cycles cardiaques dont la diastole correspond à une fréquence de 60-80 batt/min.

Figure 11.93 : Illustration du flux mitral à l’échocardiographie Doppler transoesophagienne. A : flux normal. L’onde E correspond au flux protodiastolique passif, l’onde A au flux de la contraction auriculaire. B : flux en cas de sténose mitrale. La vélocité maximale du flux (Vmax) est élevée, mais la pente de décélération du flux est très faible parce que la vidange de l’oreillette dans le ventricule est très lente ; le gradient de pression se modifie lentement et reste élevé tout au long de la diastole. La valeur de la pente de décélération du flux E permet de calculer la surface mitrale puisqu’elle est d’autant plus faible que la surface est rétrécie. En fibrillation auriculaire, l’onde A disparaît.
Comme la surface valvulaire ne se modifie pas, une augmentation du débit cardiaque (effort physique, grossesse) ou du volume diastolique (hypervolémie, transfusions, IM associée) accroît le gradient de pression de manière géométrique. Le volume systolique étant abaissé dans la SM, le gradient de pression d'une éventuelle sténose aortique associée est diminué et son degré de rétrécissement sous-estimé.
Surface d’ouverture
La surface d’ouverture de la valve mitrale en diastole peut se mesurer par la pente de décélération du flux E, par l’équation de continuité, par le PISA ou par planimétrie 2D et 3D (voir Chapitre 26 Quantification de la SM) [2].
Comme le débit à travers la valve mitrale est très lent, la POG reste élevée pendant la diastole, et le gradient de pression entre l’OG et le VG diminue très lentement. De ce fait, la décélération du flux mitral passif (flux E) est très progressive; sa pente est inversement proportionnelle à la surface d’ouverture de la valve. Cette pente permet de calculer le temps de demi-pression (Pt1/2, ou pressure half-time PHT), qui est le temps nécessaire à la pression pour diminuer de moitié (Dt), ou à la Vmax pour diminuer à une vélocité égale au pic de vélocité divisé par √2 (= 1.4), soit à 0.71 Vmax. En effet, puisque P est proportionnel à V2, le Pt1/2 est égal à 0.29 Dt (Figure 11.94). Dans une sténose mitrale, un Pt1/2 de 220 ms correspond à une surface d’ouverture de 1 cm2 ; une valeur plus élevée correspond à une surface < 1 cm2. La surface d’une sténose mitrale (Ssm) est égale à 220 divisé par le Pt1/2 mesuré : Ssm = 220 / Pt1/2 (cm2). Le résultat n’est pas valide en cas d’insuffisance aortique à cause du remplissage simultané du VG par l’IA (raccourcissement du flux mitral et surestimation du degré de sténose); l'insuffisance diastolique a le même effet. Comme la machine d'échocardiographie fait le calcul du Pt1/2, l'opérateur ne doit que tracer la pente moyenne de décélération du flux E en évitant le pic de vélocité initial si la pente y est plus aiguë, et en ne tenant pas compte du flux A pour extrapoler la droite jusqu'à la ligne de base [7].


Figure 11.94 : Quantification de la sténose mitrale. A : flux mitral diastolique au Doppler continu chez un malade en FA (absence du flux A de la contraction auriculaire) ; la Vmax est 2 m/s ; la pente de décélération du flux E est très ralentie, car le ΔP entre l’OG et le VG diminue très progressivement à cause de l’étroitesse de l’orifice mitral. B : calcul du temps de demi-pression (Pt1/2) de la pente de décélération du flux E ; c’est le temps requis pour que la pression diminue de moitié. A l'écran, le calcul s'effectue en traçant la droite correspondant à la pente moyenne (ligne pointillée bleue en A), en évitant de prendre en compte le petit décrochage accéléré au début du flux E.
L'équation de continuité stipule que le volume de sang qui traverse la mitrale (S • ITV) est le même que le volume de sang à travers la CCVG, pour autant qu'il n'y ait ni shunt ni insuffisance sur le trajet. On peut en extraire la surface S de la valve mitrale (VM): SVM = (SCCVG • ITVCCVG)/ITVVM. La mesure de l'intégrale des vélocités (ITV) dans la CCVG se fait au Doppler pulsé quelques millimètres en amont de la valve aortique, là où est mesuré le diamètre pour en calculer la surface, et celle de la valve nitrale au Doppler continu à travers la sténose. Comme les deux mesures ne peuvent pas être simultanées, la relation est faussée si le volume systolique est variable comme en FA ou en ventilation mécanique.
La zone d'accélération concentrique du flux diastolique côté auriculaire (PISA proximal isovelocity surface area) permet une autre application de l'équation de continuité. Avec une échelle de vélocité fixée à 30-40 cm/s, la vélocité du premier aliasing multipliée par la surface de l'hémisphère correspondant donne le volume sanguin pendant la durée de la diastole, qui est le même que celui qui travers la sténose mitrale pendant la même durée. On en déduit: SVM = (2 π r2 • Valias) / VVM. Comme la valve se présente en général en forme d'entonnoir, le PISA n'est pas hémisphérique mais rétréci par l'angle α formé par les feuillets; donc: SVM = (2 π r2 • Valias) / VVM • α/180. Ce calcul ne dépend pas du flux ni du débit cardiaque; il reste donc valide en cas d'IM associée. Mais la mesure du rayon r du premier aliasing est souvent difficile parce que le plan de l'orifice est malaisé à définir; or toute erreur est portée au carré dans le calcul. D'autre part, la technique du PISA suppose que l'orifice est circulaire, ce qui est rarement le cas dans ces valves déformées où il est plutôt en fente elliptique.
La planimétrie présente l’avantage de ne pas dépendre de l’hémodynamique comme le Pt1/2. La mesure est faite en méso-diastole et dans une période de fréquence cardiaque normale, car l'ouverture est incomplète lorsque la diastole est raccourcie par la tachycardie. Elle est toutefois difficile en imagerie bidimensionnelle (Figure 11.95).
- Vue court-axe basal transgastrique 0-30° : cette vue n’est pas réalisable chez tous les malades; de plus, elle est inutilisable si la valve est très clacifiée. Comme la valve a une forme conique, il n’est jamais sûr que la coupe bidimensionnelle mesure effectivement l’endroit le plus étroit; elle peut se trouver au milieu du cône et surestimer la dimension de la valve.
- Reconstruction tridimensionnelle (full volume) : l’imagerie 3D évite ce piège puisqu’elle reconstruit l’ensemble des feuillets et permet de faire la mesure à l’endroit exact qui est le plus étroit. La reconstruction 3D est actuellement considérée comme la mesure-étalon de la surface d’ouverture de la valve lors de sténose mitrale.
- Des algorithmes de remodelage paramétrique permettent d'extraire d'une acquisition en full-volume la représentation tridimensionnelle de l'anneau et des feuillets, et d'y faire des mesures comme la surface exacte de ceux-ci, quelle que soit leur forme. Ainsi l'orifice diastolique maximal d'une sténose mitrale est obtenu sans présupposé géométrique comme la surface qui manque à la surface totale des feuillets pour correpondre à celle ceinturée par l'anneau. Comparée aux autres techniques de mesure de la surface mitrale (équation de continuité, PISA, Pt1/2), cette procédure donne des valeurs environ 30% plus faibles; seule la planimétrie 3D fournit des données voisines [3].


Figure 11.95 : Planimétrie de la surface d’ouverture d’une sténose mitrale serrée. A : en vue bidimensionnelle court-axe transgastrique 0° ; la surface mesurée est de 0.976 cm2. B : en vue tridimensionnelle depuis le ventricule gauche. Comme la valve a une forme conique, il n’est jamais sûr que la coupe bidimensionnelle mesure effectivement l’endroit le plus étroit ; elle peut se trouver au milieu du cône et surestimer la dimension de la valve. L’imagerie 3D évite ce piège puisqu’elle reconstruit l’ensemble des feuillets et permet de faire la mesure à l’endroit exact qui est le plus étroit. D: reconstruction paramétrique de l'anneau et des feuillets mitraux à partir d'une image full-volume (C) en cas de sténose. Images diastoliques démontrant la faible ouverture de la valve; les zônes colorées en bleu sont situées en-dessous du plan de l'anneau. La reconstruction 3D est actuellement considérée comme la mesure étalon de la surface d’ouverture de la valve lors de sténose mitrale [extrait de: Poelaert JI, Bouchez S. Perioperative echocardiographic assessment of mitral valve regurgitation: a comprehensive review. Eur J Cardio-Thor Surg 2016; 50:801-12].
Les caractéristiques de la sténose mitrale serrée sont synthétisées dans le schéma illustré à la Figure 11.96. Il est important de fonder le diagnostic sur un faisceau de preuves concordantes et non sur une seule donnée isolée.

Figure 11.96 : Résumé schématique des caractéristiques échocardiographiques de la sténose mitrale sévère. La silhouette est caractéristique : immense OG avec contraste spontané, appendice auriculaire gauche (AAG) dilaté, abritant fréquemment un thrombus en cas de FA, petit VG, feuillets mitraux déformés et restrictifs avec fusion commissurale, appareils sous-valvulaire restrictif, épaissi et raccourci. Au Doppler, zone d’accélération concentrique côté auriculaire (PISA) en diastole, flux transmitral accéléré (Vmax 2 m/s) et zone tourbillonnaire intraventriculaire, gradient moyen élevé (≥ 12 mmHg), temps de demi-pression (Pt1/2) > 220 ms.
Cathétérisme
Le cathétérisme n’est indiqué que si les conclusions de l’échocardiographie sont douteuses ou que ses résultats sont discordants, y compris après une échocardiographie de stress [5]. Il est inutile si l’échocardiographie est claire et concordante avec la symptomatologie clinique. L’angiographie coronarienne est indiquée si l’on suspecte une maladie coronarienne ; elle est recommandée au-delà de 45 ans chez l’homme et de 50 ans chez la femme lorsqu’on envisage une intervention en CEC [1]. Le cathétérisme droit peut être nécessaire en présence de BPCO sévère ou d’hypertension pulmonaire grave.
| Echocardiographie en cas de sténose mitrale sévère |
|
Silhouette bidimensionnelle caractéristique :
- Immense OG avec contraste spontané, petit VG
- Appendice auriculaire gauche (AAG) dilaté, abritant fréquemment un thrombus en cas de FA
- Feuillets mitraux déformés et restrictifs avec fusion commissurale
- Appareil sous-valvulaire restrictif, épaissi et raccourci
Au Doppler couleur : - Zone d’accélération concentrique côté auriculaire (PISA) en diastole
- Flux transmitral accéléré (Vmax > 2 m/s)
- Zone tourbillonnaire intraventriculaire
Gradient moyen élevé (≥ 12 mmHg) Temps de demi-pression (Pt1/2) > 220 ms
Planimétrie 3D: surface < 1 cm2/m2
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- BRAUNWALD E. Valvular heart disease. In: BRAUNWALD E. ed. Heart disease. Philadelphia, WB Saunders Co, 1997, 1007-76
- CHERRY AD, MAXWELL CD, NICOARA A. Intraoperative evaluation of mitral stenosis by transesophageal echocardiography. Anesth Analg 2016; 123:14-20
- KARAMNOV S, BURBANO-VERA N, HUANG CC, et al. Echocardiographic assessment of mitral stenosis orifice area: a comparison of a novel three-dimensional method versus conventional techniques. Anesth Anlg 2017; 125:774-80
- MICHELENA HI, ABEL MD, SURI RM, et al. Intraoperative echocardiography in valvular heart disease: An evidence-based appraisal. Mayo Clin Proc 2010; 85:646-55
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- WILKINS GT, WEYMAN AF, ABASCAL VM, et al. Percutaneous balloon dilatation of the mitral valve: en analysis of echocardiographic variables related to outcome and the mechanism dilatation. Br Heart J 1988; 60:299307
- WUNDERLICH NC, BEIGEL R, SIEGEL RJ. Management of mitral stenosis using 2D and 3D echo-Doppler imaging. JACC Cardiovasc Imaging 2013; 61:1191-205
