Médicaments anti-arythmiques
L’arsenal médicamenteux à disposition de l’anesthésiste est considérable. La liste suivante n’est pas exhaustive, mais rassemble les principales substances utilisées en clinique. Leurs indications selon les pathologies figurent dans le Tableau 20.7 [29].
- Esmolol (Brevibloc®) : 0.5 mg/kg iv en 1 min ; perfusion 0.05-0.2 mg/kg/min ; risque d’hypotension et de bradycardie passagères.
- Metoprolol (Belok®) : 1-5 mg iv en 2 min ; 50-300 mg/j per os ; risque d’hypotension et d’insuffisance ventriculaire.
- Sotalol (Sotalex®) : 1 mg/kg iv ; risque d’hypotension, de bradycardie, de torsades de pointe.
- Diltiazem (Dilzem®) : 0.3 mg/kg iv en 10 min, perfusion 5-15 mg/h ; risque d’hypotension.
- Verapamil (Isoptin®) : 2.5-10 mg iv en 10 min ; très inotrope négatif, contre-indiqué en cas d’insuffisance ventriculaire.
- Lidocaïne (Xylocaïne®) : 1.0-1.5 mg/kg iv; risque d'élévation du seuil de défibrillation.
- Digoxine (Digoxine®) : 0.25-1.0 mg iv lent, 0.125-0.5 mg/j per os ; risque de bloc AV ; contrôler la kaliémie.
- Vernakalant (Brinavess®): 3 mg/kg perfusion iv en 10 min, suivi d'une seconde perfusion (2 mg/kg) après 15 minutes si la FA persiste; profil de sécurité supérieur à celui des autres substances.
- Amiodarone (Cordarone®) : 2.5-5 mg/kg iv en 20 min, puis 15 mg/kg en 24 heures ; risque d’hypotension et de bradycardie ; long terme : dysfonction thyroïdienne (10% des cas) et hépatique, fibrose pulmonaire, photosensibilisation.
- Dronédarone (Multaq®): 400 mg 2 x/j; contre-indications: bloc AV, QT long, insuffisance ventriculaire, insuffisance hépatique.
- Procaïnamide (Procaïne®) : 0.5-1 gm iv à 50 mg/min ; contre-indiqué en cas d’insuffisance rénale ; risque de fièvre, syndrome lupique.
- Flecaïnide (Tambocor®) : 1-2 mg/kg en 10-30 min ; contre-indiqué en cas de coronaropathie, de valvulopathie et de dysfonction ventriculaire.
- Ibutilide (Corvert®) : 1 mg iv en 10 min, à répéter après 10 min si nécessaire ; risque de torsades de pointe.
- Propafenone (Rytmonorm®) : 2 mg/kg iv en 10-20 min ; risque d’hypotension et de décompensation ventriculaire ; contre-indiqué en cas d’insuffisance cardiaque.
- Adénosine (Krenosine®, Arteriotonine®) : 6 mg bolus iv, répéter avec 12 mg si insuccès.
- Disopyramide (Rythmodan®) : 2 mg/kg iv, puis 0.4 mg/kg/h ; risque de rétention urinaire, contre-indiqué en cas de glaucome.
- Dofetilide (Tikosyn®) : 4-8 mcg/kg iv ; risque de torsades de pointe, ajuster les doses en cas d’insuffisance rénale.
- Ivabradine (Procoralan®): 2.5-7.5 mg 2x/j selon la fréquence cardiaque.

Le traitement des arythmies doit toujours envisager en premier lieu la correction des éléments médicaux modifiables: troubles électrolytiques, acidose, hypoxie, sepsis, etc. En cas de FA, la cardioversion électrique (50-150 J) est préférable chez les patients symptomatiques ou hémodynamiquement instables, a fortiori s'ils sont endormis et intubés en salle d'opération ou aux soins intensifs [32].
Anticoagulation
L'adjonction d'un traitement anticoagulant dépend du risque de thrombo-embolie et d'AVC, indépendamment du type et de la durée de la FA [21]. Celui-ci est évalué par un score de risque comme le score CHA2DS2-VASc (voir Tableau 20.3) [24]. L'anticoagulation est nécessaire lorsque le score est ≥ 2, variable selon le risque hémorragique pour un score de 1, et inutile pour un score de 0 chez l'homme ou de 1 chez la femme [21,22]. La cardioversion pour une FA durant depuis > 48 heures, qu'elle soit médicamenteuse ou électrique, est un moment critique à cause du danger d'embolisation d'un thrombus auriculaire, en général situé dans l'appendice auriculaire gauche. Il est donc impératif de s'assurer de l'absence de thrombus par une échocardiographie transoesophagienne (ETO). Si celle-ci n'est pas faisable ou si un caillot est présent, le malade doit poursuivre 3 semaines d'anticoagulation avant la cardioversion. La durée du traitement après une cardioversion réussie est au minimum de 1-2 mois, après quoi sa prolongation dépend du risque thrombo-embolique; avec un score ≥ 2, il est continué à vie [17]. Pendant des décennies, l'anticoagulation a été fondée sur l'utilisation d'agents anti-vitamine K (AVK) en visant un INR entre 2.0 et 3.0, mais l'arrivée des nouveaux anticoagulants oraux (NACO) comme le dabigatran (Pradaxa®) et les xabans (Xarelto®, Eliquis®, Lixiana®) a changé la donne, car ces substances sont efficaces, pratiques (pas de contrôles), de courte demi-vie (< 12 heures) et occasionnent moins de saignements majeurs ou d'hémorragies intracrâniennes [15]. Les NACO sont indiqués dans toutes les formes de FA, sauf en cas de prothèse valvulaire mécanique, de bioprothèse, de sténose mitrale rhumatismale et/ou de plastie mitrale avec matériel prothétique; les AVK sont requis dans ces cas (INR 2.5-3.0) [12,21].
Lorsque les malades anticoagulés doivent subir une interventiuon chirurgicale, les délais d’interruption préopératoire minimaux habituellement proposés sont les suivants en cas de risque hémorragique standard (Tableau 20.8).
- Héparine non-fractionnée 4-6 heures
- HBPM prophylactique 12 heures (contre-indication: insuffisance rénale)
- HBPM thérapeutique 24 heures (contre-indication: insuffisance rénale)
- Dabigatran (Pradaxa®) 48 h (4-5 jours si clairance créatinine < 50 mL/min)
- Apixaban (Eliquis®) 48 h (3-4 jours si clairance créatinine < 50 mL/min)
- Edoxaban (Lixiana®) 48 h (3-4 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 5-10 mg 24 h (3 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 15-20 mg 48 h (3-5 jours si clairance créatinine < 50 mL/min)
- Sintrom®, Coumadine® 5 jours (contrôle INR à J-5 et J-1)
- Marcoumar® 10 jours (contrôle INR à J-10 et J-1)

Ces délais sont basés sur une attente correspondant à 3 demi-vies d’élimination. Pour les interventions à haut risque hémorragique ou pour l'anesthésie loco-régionale rachidienne, il est recommandé d'attendre 5 demi-vies, soit 72 heures. Sont considérés comme haut risque hémorragique les opérations en espace clos (crâne, rachis, chambre postérieur de l'œil) et les opérations avec saignement majeur ou hémostase dificile. En cas d’insuffisance rénale, les délais sont doublés pour les substances éliminées par les reins [12,17,27]. Les interventions au cours desquelles les risques de saignement sont faibles ou minimes (pace-makers, cathétérisme, endoscopie, chirurgie de paroi) ne nécessitent aucune interruption du traitement (voir Chapitre 8 Gestion périopératoire).
Pendant le délai d'attente, la substitution par une héparine augmente de 3 à 5 fois le risque hémorragique sans mettre à l’abri des complications thrombotiques: le risque de saignement mineur et majeur est accru (HR 5.4 et 3.6, respectivement), alors que le risque thrombo-embolique est inchangé (HR 0.84) [3,12,13,35]. Dans l’état actuel de nos connaissances, la substitution n’est donc indiquée que chez les malades à très haut risque thrombotique qui sont sous AVK (score CHA2DS2-VASc élevé, prothèse valvulaire mécanique, anamnèse d'AVC); elle est inutile et potentiellement dangereuse lors de l'interruption des NACO (voir Chapitre 8 Substitution).
La reprise postopératoire de l'anticoagulation est impérative car le risque thrombotique est accru après l'intervention, mais elle est conditionnée par la qualité de l'hémostase et par les éventuelles conséquences d'une hémorragie (saignement en espace clos). Les AVK peuvent être redémarrés dans les premières 24 heures, car leur effet ne se fera sentir qu'au-delà de 3 jours. Les NACO, par contre, sont efficaces 1-3 heures après leur ingestion. Avec les premiers, il est judicieux d'utiliser une HBPM à dose prophylactique pendant 72 heures chez les malades à haut risque thrombo-embolique. Avec les seconds, la substitution est inutile, voir dangereuse; le délai de reprise est de 12-72 heures selon le risque hémorragique [12]. Après des interventions majeures, il faut tenir compte du fait que la fonction rénale peut être perturbée pendant de nombreux jours et que la dose de NACO doit y être adaptée. Tant que la voie orale est exclue, une HBPM de remplacement est recommandée; comme la pharmacocinétique des HBPM et des NACO est analogue, il ne doit pas y avoir de superposition des deux thérapeutiques.
Il arrive qu’une FA survienne au cours d’un syndrome coronarien aigu ou chez un malade sous antiplaquettaires après la pose de stents. Cette situation impose une anticoagulation en sus des antiplaquettaires. Cette triple thérapie comporte évidemment un risque hémorragique accru : le taux de saignement est augmenté de 1.6 à 4 fois par rapport à la bithérapie [8]. De ce fait, seul le clopidogrel entre en ligne de compte dans cette situation, le ticagrelor et le prasugrel étant trop hémorragipares. D'autre part, la triple thérapie est limitée à 1-3 mois [8,21,37]. La combinaison des antiplaquettaires avec un nouvel anticoagulant oral est moins hémorragipare que l’association à la warfarine [21]. La stratégie consiste donc à raccourcir autant que possible la durée de la trithérapie pour passer à une bithérapie: dès 3 mois après un SCA, mais dès 1 mois en cas de coronaropathie stable et/ou de risque hémorragique élevé. La bithérapie consiste de préférence en clopidogrel en combinaison avec un nouvel anticoagulant oral (dabigatran, rivaroxaban, apixaban), sans aspirine; si le risque hémorragique est faible, on peut remplacer le clopidogrel par le ticagrelor [8]. Lorsque la coronaropathie est stable au-delà d'une année après revascularisation, le traitement peut être réduit à une monothérapie par un NACO (rivaroxaban 15 mg/j) [38].
Il arrive qu’une FA survienne au cours d’un syndrome coronarien aigu ou chez un malade sous antiplaquettaires après la pose de stents. Cette situation impose une anticoagulation en sus des antiplaquettaires. Cette triple thérapie comporte évidemment un risque hémorragique accru : le taux de saignement est augmenté de 1.6 à 4 fois par rapport à la bithérapie [8]. De ce fait, seul le clopidogrel entre en ligne de compte dans cette situation, le ticagrelor et le prasugrel étant trop hémorragipares. D'autre part, la triple thérapie est limitée à 1-3 mois [8,21,37]. La combinaison des antiplaquettaires avec un nouvel anticoagulant oral est moins hémorragipare que l’association à la warfarine [21]. La stratégie consiste donc à raccourcir autant que possible la durée de la trithérapie pour passer à une bithérapie: dès 3 mois après un SCA, mais dès 1 mois en cas de coronaropathie stable et/ou de risque hémorragique élevé. La bithérapie consiste de préférence en clopidogrel en combinaison avec un nouvel anticoagulant oral (dabigatran, rivaroxaban, apixaban), sans aspirine; si le risque hémorragique est faible, on peut remplacer le clopidogrel par le ticagrelor [8]. Lorsque la coronaropathie est stable au-delà d'une année après revascularisation, le traitement peut être réduit à une monothérapie par un NACO (rivaroxaban 15 mg/j) [38].
Fibrillation auriculaire
Le taux de succès d’une cardioversion pharmacologique de la FA avec l’amiodarone (300 mg iv) est élevé (86% à 24 heures) mais prend du temps [9]. Le vernakalant est actuellement le médicament le plus efficace, avec un taux de conversion de FA en rythme sinusal de 52% à 90 minutes, alors que l'amiodarone n'a qu'un taux de 5% à ce délai [7]. Les substances des classes 1a (procaïnamide), 1c (propafénone) et III (ibutilide, dofétilide) sont également utiles pour réduire la FA, mais allongent le QT et peuvent induire des torsades de pointe [30]. La clef du traitement à long terme est le contrôle de la fréquence ventriculaire avec une substance qui ralentit la conduction AV (classe II ou IV) : β-bloqueur, anti-calcique [25].
| Traitement médicamenteux |
|
La première étape est de contrôler les éléments modifiables: troubles électrolytiques, acidose, hypoxie, sepsis, etc. Chez un malade endormi, les tachy-arythmies non supportées hémodyna-miquement sont interrompues par cardioversion ou défibrillation.
Dans la FA, la conversion en rythme sinusal est plus rapide avec le vernakalant qu'avec l'amiodarone. Le contrôle de la fréquence est opéré par β-bloqueur, digoxine ou anti-calcique. L'anticoagulation est assurée par un agent anti-vitamine K, un xaban ou le dabigatran. Les nouveaux anticoagulants oraux (NACO) sont réservés aux FA non-valvulaires.
|
Ablation chirurgicale de la FA
La cartographie de la propagation de la dépolarisation et de la repolarisation au sein des oreillettes montre une progression normalement régulière depuis le nœud du sinus. Chez le malade en FA, la progression est désorganisée. Les fronts d’onde sont irréguliers, et rencontrent des tissus parfois excitables parfois réfractaires ; le front de dépolarisation peut retourner en arrière stimuler des zones préalablement réfractaires et installer des circuits de réentrée entre des zones de différents degrés d’activation et de repolarisation (Figure 20.20) [2,10]. Ces zones ont des localisations préférentielles, notamment autour des veines pulmonaires, de la paroi postérieure de l’OG, et de l’appendice auriculaire gauche [36].
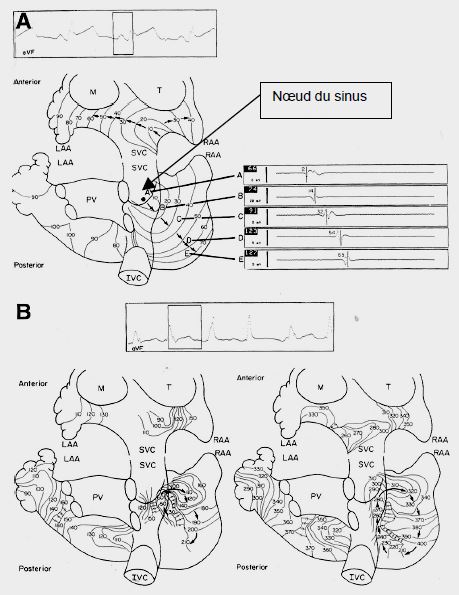
Figure 20.20 : Cartographie de la séquence d’activation électrique des oreillettes. Chaque courbe représente des fronts isochrones espacés de 10 ms. A : situation normale ; la progression depuis le nœud du sinus est harmonieuse sur toute la surface des oreillettes. B : séquence d’activation d’un patient en FA ; la progression est anarchique ; il existe un foyer de réentrée proche du nœud du sinus tournant en sens anti-horaire. LAA : appendice auriculaire gauche. RAA : appendice auriculaire droit. SVC : veine cave supérieure. IVC : veine cave inférieure. M : valve mitrale. T : valve tricuspide [10].
On peut interrompre chirurgicalement les circuits de réentrée par une incision ou une scarification transmurale de la paroi auriculaire (opération de Cox-maze) [16]. Il s’agit d’isoler l’origine des veines pulmonaires, d’exciser l’appendice auriculaire gauche, et d’interrompre les circuits de réentrée les plus courants par des incisions qui dirigent l’influx du nœud du sinus vers le nœud AV, en ménageant des culs-de-sac pour activer le reste des oreillettes sans possibilité de conduction ni de réentrée, d’où l’analogie avec un labyrinthe (maze) (Figure 20.21) [11].

Figure 20.21 : Opération de maze. Les lignes d’incision ou d’ablation thermique (en rouge) interrompent les trajets les plus fréquemment empruntés par les circuits ré-entrants et redirigent les influx du nœud du sinus vers le nœud AV par un circuit complexe assurant le délai AV. Les deux oreillettes restent activables par les stimulations du sinus, mais celles-ci aboutissent dans des voies sans issue qui empêchent la conduction et la formation de circuits de réentrée [d’après réf 36].
A cet effet, on peut utiliser une thermo-ablation par ondes herziennes ou micro-ondes (60°C), ou une cryo-ablation avec une sonde à circulation d’azote liquide (- 50°C). L’opération a lieu en CEC sous arrêt par cardioplégie. Elle est le plus souvent réalisée en association avec une autre intervention cardiaque (pontages aorto-coronariens, chirurgie valvulaire). Le risque hémorragique et le prolongement du temps opératoire sont modérés (voir Anesthésie pour ablation interventionnelle).
Les résultats à long terme montrent que 60-82% des malades restent en rythme sinusal par la suite, même si les oreillettes ne contribuent que partiellement au remplissage ventriculaire parce que leur force propulsive est réduite [6,26,34]. La sécrétion de peptide natriurétique étant diminuée par cette intervention, particulièrement lorsqu'on résèque l'appendice auriculaire droit, les malades présentent souvent une rétention hydrique dans le postopératoire [1].
Ablation par cathétérisme
De manière moins invasive, il est possible de procéder à une ablation des circuits de réentrée dans la FA ou dans d'autres tachyarythmies par voie endovasculaire au moyen de sondes fonctionnant par thermo-ablation (radiofréquence, 60° C), cryo-ablation (-50° C) ou laser. Le point principal est d'isoler l'origine des veines pulmonaires dans la paroi postérieure de l'OG, car leur implantation est le foyer essentiel des circuits de réentrée dans la FA paroxystique; on y ajoute en général l'isolation de l'appendice auriculaire gauche et des lignes transverses au corps de l'oreillette dans les cas de FA persistante (Figure 20.22).

Figure 20.22 : Vue schématique de l'OG avec l'insertion des 4 veines pulmonaires sur la face postérieure et de l'appendice auriculaire gauche (AAG) sur la face antéro-latérale gauche. Les tracés de la scarification endovasculaire sont représentés par les traitillés bleus: isolation de la racine des veines pulmonaires de chaque côté, isolation de l'implantation de l'AAG, lignes accessoires entre les VP droites et gauches, et entre les VP gauches et l'AAG, ligne verticale en direction de l'anneau mitral. VPSG: veine pulmonaire supérieure gauche. VPIG: veine pulmonaire inférieure gauche. VPSD: veine pulmonaire supérieure droite. VPID: veine pulmonaire inférieure droite.
Les indications sont une FA ou un flutter symptomatiques récurrents ou persistants en présence d'une intolérance ou d'une contre-indication aux anti-arythmiques de classe I ou III; les patients en insuffisance ventriculaire tirent un bénéfice maximal de l'ablation [20,23]. Cette thérapeutique évite les effets secondaires des anti-arythmiques et présente un taux de conversion en rythme sinusal de 89% à 1 an, au lieu de 23% avec les agents antiarythmiques [19]. L'eurythmie est maintenue à long terme dans 80% des cas de FA paroxystique et dans 60-70% des cas de FA persistante, les deux tiers des patients étant dispensés de tout traitement médicamenteux [18]. Avec les nouveaux anticoagulants oraux (dabigatran, xabans) comme avec les AVK, il n'est pas nécessaire d'interrompre le traitement pour la procédure, mais il est recommandé de le continuer dans le postopératoire pour 1-2 mois [14]. Si le score CHA2DS2-VASc est faible (0-1) et si le malade est en rythme sinusal, l'anticoagulation peut être arrêtée à ce moment, mais si le score est ≥ 2, elle doit être continuée à vie [20,21].
L'ablation interventionnelle par cathétérisme procède en cinq phases [28].
- Accès vasculaire, en général par une veine fémorale, mise en place des cathéters sont contrôle fluoroscopique.
- Induction artificielle des arythmies (stimulation électrique, perfusion d'isoprénaline 1-3 mcg/min).
- Localisation de la source par cartographie (mapping) au moyen de fluoroscopie, de reconstruction 3D électro-anatomique (Carto™, Ensite NavX™) ou de localisation GPS; certains centres utilisent l'échocardiographie intracardiaque ou transoesophagienne.
- Ablation par scarification endocavitaire (thermo- ou cryo-ablation); contrôle de la température oesophagienne, qui ne doit pas s'élever de plus de 1°C par rapport à sa valeur de base.
- Test pour confirmer la disparition effective des stimulations ectopiques ou des réentrées.
L'intervention se déroule sous anticoagulation complète par bolus (160-180 UI/kg) et perfusion (4'000-5'000 UI/heure) d'héparine non-fractionnée pour un ACT de 300-400 secondes; cette valeur doit être atteinte lorsque le cathéter pénètre dans l'OG par ponction trans-septale [5,33]. Cette anticoagulation n'est pas requise si le cathétérisme se cantonne au cœur droit (ablation de TV originaire de la chambre de chasse du VD, par exemple). L'héparine est renversée par de la protamine en fin d'intervention, mais l'anticoagulation orale est continuée dans le postopératoire pour 1-2 mois [14].
La même procédure de thermo- ou cryo-ablation est utilisée dans les autres cas de tachycardie par réentrée, comme le syndrome de Wolff-Parkinson-White, la tachycardie du nœud AV, la tachycardie jonctionnelle ou la tachycardie ventriculaire (TV); le taux de succès électrique est de 90-95% [31]. Dans les cas de flutter auriculaire, l'ablation par radio-fréquence se fait au niveau de l'isthme entre la valve tricuspide et la veine cave inférieure (OD). Les complications du cathétérisme interventionnel sont la tamponnade par perforation (1% des cas), l'AVC par mobilisation de thrombus (1% des cas), les lésions vasculaires (1% des cas), la paralysie phrénique (lésion par cryo-ablation) et la fistule atrio-oesophagienne (rare mais mortelle dans 75% des cas) [23,28].
Dans les cas où l'anticoagulation présente trop de risque (score HAS-BLED très élevé) par rapport à son bénéfice (score CHA2DS2-VASc bas), il est possible d'exclure l'appendice auriculaire gauche, qui est la source principale des thrombi; on peut alors se passer d'anticoagulant [21]. Plusieurs dispositifs introduits par voie veineuse et trans-septale permettent d'occlure mécaniquement l'AAG: Watchman™, Amplatzer™, Lariat™ (voir Chapitre 10, Interventions non-valvulaires et Figure 10.41). D'autres systèmes introduits par voie endoscopique dans l'espace péricardique permettent de clipper ou de suturer l'AAG de l'extérieur [4]. Dans ces conditions, les malades restent simplement sous aspirine.
La prise en charge anesthésique est décrite plus loin (voir Anesthésie pour ablation interventionnelle).
| Traitement interventionnel de la tachyarythmie |
|
Opération de maze pour la FA: consiste à isoler l’origine des veines pulmonaires, à exciser l’appendice auriculaire gauche, et à interrompre les circuits de réentrée les plus courants par des incisions qui dirigent l’influx du nœud du sinus vers le nœud AV, en ménageant des culs-de-sac pour activer le reste des oreillettes sans possibilité de conduction ni de réentrée. Intervention en CEC sous arrêt par cardioplégie, indiquée en cas de chirurgie cardiaque concommittante.
Ablation par cathétérisme: en cas de FA, scarification endocavitaire par thermo- ou cryo-ablation autour de l'origine des veines pulmonaires et de l'appendice auriculaire gauche, en ajoutant si nécessaire des lignes d'interruption de la propagation des circuits de réentrée dans le corps de l'OG. Indications: FA ou flutter symptomatiques persistants en présence d'une intolérance ou d'une contre-indication aux anti-arythmiques lorsque le contrôle de la fréquence est insuffisant. Taux de conversion en rythme sinusal de 89% à 1 an, au lieu de 23% avec les agents antiarythmiques.
La même procédure de thermo- ou cryo-ablation est utilisée dans le syndrome de Wolff-Parkinson-White, la tachycardie du nœud AV, la tachycardie jonctionnelle ou la tachycardie ventriculaire (TV); le taux de succès électrique est de 90-95%.
|
© CHASSOT PG, RANCATI V, Mars 2008, dernière mise à jour, Décembre 2019
Références
- ALBÅGE A, VAN DER LINDEN J, BENGTSSON L, et al. Elevations in antidiuretic hormone and aldosterone as possible causes of fluid retention in the maze procedure. Ann Thorac Surg 2001; 72:58-64
- ALLESSIE MA, BOYDEN PA, CAMM AJ, et al. Pathophysiology and prevention of atrial fibrillation. Circulation 2001; 103:769-77
- BEYER-WESTENDORF J, GELBRICHT V, FORSTER K, et al. Peri-interventional management of novel oral anticoagulants in daily care : results from prospective Dresden NOAC registry. Eur Heart J 2014 ; 35:1888-96
- BHATT HV, FISHER GW. Atrial fibrillation: pathpophysiology and therapeutic options. J Cardiothorac Vasc Anesth 2015; 29:1333-40
- BHATT HV, SYROS G, GRECO M, et al. Ablation therapy for atrial fibrillation: implications for the anesthesiologist. J Cardiothorac Vasc Anesth 2015; 29:1341-56
- BUDERA P, STRAKA Z, OSMANCIK P, et al. Comparison of cardiac surgery with left atrial surgical ablation vs cardiac surgery without atrial ablation in patients with coronary and/or valvular heart disease plus atrial fibrillation; final results of the PRAGUE-12 randomized multicenter study. Eur Heart J 2012; 33:2644-52
- CAMM AJ, CAPUCCI A, HOHNLOSER SH, et al. A randomized active-controlled study comparing the efficacy of vernakalant to amiodarone in recent-onset atrial fibrillation. J Am Coll Cardiol 2011; 57:313-21
- CAPODANNO D, HUBER K, MEHRAN R, et al. Management of antithrombotic therapy in atrial fibrillation patients undergoing PCI. JACC state-of-the-art review. J Am Coll Cardiol 2019; 74:83-99
- CHEVALIER P, DURAND-DUBIEJ A, BURRI H. Amiodarone versus placebo and class IC drugs for cardioversion of recent-onset atrial fibrillation: a meta-analysis. J Am Coll Cardiol 2003; 41:255-62
- COX JL, CANAVAN TE, SCHUESSLER RB, et al. The surgical treatment of atrial fibrillation: II. Intraoperative electrophysiologic mapping and description of the electrophysiologic basis of the atrial flutter and atrial fibrillation. J Thorac Cardiovasc Surg 1991; 101:406-26
- COX JL, SCHUESSLER RB, BOINEAU JP. The development of the Maze procedure for the treatment of atrial fibrillation. Semin Thorac Cardiovasc Surg 2000; 12:2-14
- DOHERTY JU, GLUCKMAN TJ, HUCKER WJ, et al. 2017 ACC expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017; 69:871-98
- DOUKETIS JD, SPYROPOULOS AC, KAATZ S, et al. Perioperative bridging anticoagulation in patients with atrial fibrillation. N Engl J Med 2015; 373:823-33
- EITEL C, KOCH J, SOMMER P, et al. Novel oral anticoagulants in a real-world cohort of patients undergoing catheter ablation of atrial fibrillation. Europace 2013; 15:1587-93
- GALANIS T, THOMSON L, PALLADINO M, et al. New oral anticoagulants. J Thromb Thrombolysis 2011; 31:310-20
- GILLINOV AM, BLACKSTONE EH, McCARTHY PM. Atrial fibrillation: current surgical options and their assessment. Ann Thorac Surg 2002; 74:2210-7
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015 ; 17:1467-507
- HUNTER RJ, McCREADY J, DIAB I, et al. Maintenance of sinus rhythm with an ablation strategy in patients with atrial fibrillation is associated with a lower risk of stroke and death. Heart 2012; 98:48-53
- JAÏS P, CAUCHEMEZ B, MACLE L, et al. Catheter ablation versus antiarrhythmic drugs for atrial fibrillation: the A4 Study. Circulation 2008; 118:2498-505
- JANUARY CT, WANN LS, ALPERT JS, et al. 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation. J Am Coll Cardiol 2014; 64: e1-76
- JANUARY CT, WANN LS, CALKINS H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation. J Am Coll Cardiol 2019; 74:104-32
- KIRCHHOF P, BENUSSI S, KOTECHA D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016; 37:2893-962
- LINK MS, HAÏSSAGUERRE M, NATALE A. Ablation of atrial fibrillation. Patient selection, periprocedural anticoagulation, techniques, and preventive measures after ablation. Circulation 2016; 134:339-52
- LIP GY, NIEUWLAAT R, PFISTERS R, et al. Refining clinical riak stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on Atrial Fibrillation. Chest 2010; 137:263-72
- MAYR A, RITSCH N, KNOTZER H, et al. Effectiveness of direct-current cardioversion for treatment of supraventricular tachyarrhythmias, in particular atrial fibrillation, in surgical intensive care patients. Crit Care Med 2003; 31:401-5
- McCARTHY PM; GILLINOV AM, CASTLE L, et al. Cox-maze procedure for atrial fibrillation: Cleveland Clinic experience. Semin Thorac Cardiovasc Surg 2000; 12:25-9
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- NICOARA A, HOLMQUIST F, RAGGAINS C, et al. Anesthesia for catheter ablation procedures. J Cardiothorac Vasc Anesth 2014; 28:1589-603
- PALIN CA, HOGUE CW. Atrial and ventricular arrhythmia management. In: CHENG DCH, et al, eds. Perioperative care in cardiac anesthesia and surgery. Philadelphia: Lippincott, Williams & Wilkins, 2006, 359-68
- PALIN CA, KAILASAM R, HOGUE CW. Atrial fibrillation after cardiac surgery: pathophysiology and treatment. Semin cardiothorac Vasc Anesth 2004; 8:175-83
- PATEL KD, CROWLEY R, MAHAJAN A. Cardiac electrophysiology procedures in clinical practice. Intern Anesthesiol Clin 2012; 50:90-110
- PHILIP I, BERROËTA C, LEBLANC I. Perioperative challenges of atrial fibrillation. Curr Opin Anesthesiol 2014; 27:344-52
- RAVAL AN, CIGARROA JE, CHUNG MK, et al. Management of patients on non-vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting. Circulation 2017; 135:e604-e633
- SCHAFF HV, DEARANI JA, DALY RC, et al. Cox-maze procedure for atrial fibrillation: Mayo Clinic experience. Semin Thorac Cardiovasc Surg 2000; 12:30-7
- SIEGAL D, YUDIN J, KAATZ S, et al. Periprocedural heparin bridging in patients receiving vitamin K antagonists : systematic review and meta-analysis of bleeding and thromboembolic rates. Circulation 2012 ; 126 :1630-9
- SUNDT TM, CAMILLO CT, COX JL. The maze procedure for cure of atrial fibrillation. Cardiol Clin 1997; 15:739-48
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Hesrt J 2018; 39:213-54
- YASUDA S, KAIKITA K, AKAO M, et al. Antithrombotic therapy for atrial fibrillation with stable coronary disease. N Engl J Med 2019; 381:1103-13
