L’insuffisance aortique (IA) représente une surcharge de volume pour le VG, que celui-ci compense par une augmentation de son volume télédiastolique. Cette augmentation de précharge lui permet de maintenir un volume systolique adéquat (principe de Frank-Starling); de plus, la tachycardie élève le débit cardiaque. Pour le VG, l’augmentation de sa tension de paroi par la dilatation est l’équivalent d’une élévation de postcharge en protosystole; elle induit une hypertrophie excentrique. A la différence de l’insuffisance mitrale (IM), où la fuite dans l’OG maintient la postcharge basse malgré l’excès de volume systolique, l’insuffisance aortique oblige le VG à éjecter tout le volume dans l’aorte, qui est un système à haute pression. D'autre part, la pression d’amont de la régurgitation est la pression diastolique aortique (40-80 mmHg), qui est bien supérieure à la pression de l’OG en systole (5-10 mmHg). Dans l'IA, les RAS contrôlent directement la postcharge du VG en systole et la fraction régurgitée en diastole. La diminution des RAS est donc doublement importante pour le fonctionnement du VG.
- L’IA diminue si la PAdiast baisse;
- L’éjection du VG est améliorée si la PAsyst baisse.
Comme elle est à la fois une surcharge de volume et de pression, l’IA est moins bien tolérée que l’IM [4]. La quantité de sang régurgitée de l’aorte dans le VG dépend de:
- La surface de l’orifice maintenu ouvert en diastole (IA sévère : > 0.3 cm2).
- La durée de la diastole: la bradycardie prolonge la durée de la diastole, donc le volume de la régurgitation.
- Le gradient de pression entre l’aorte et le VG en diastole: il dépend de la pression dans l’aorte ascendante, des RAS et de la compliance ventriculaire; il est le plus élevé en protodiastole et s'amenuise d'autant plus vite que l'IA est plus importante (équilibration rapide de la pression aortique et de la pression intraventriculaire).
La tachycardie raccourcit la diastole, et le volume régurgité par cycle cardiaque diminue. De ce fait, la dilatation du VG est freinée. La bradycardie représente un danger majeur à cause du remplissage exagéré du VG lors de longues diastoles pendant lesquelles l’IA déverse une grande quantité de sang dans le ventricule. La fréquence optimale se situe probablement autour de 80-90 batt/minute. Il est certainement dangereux de descendre en-dessous de 60 batt/minute.
Insuffisance aortique chronique
La dilatation ventriculaire accroissant le stress de paroi (σ), le VG va s’épaissir et s’hypertrophier pour maintenir normale cette tension (loi de Laplace : σ = (P • r) / 2h). Ceci conduit à une hypertrophie excentrique ou dilatative par réplication en série des sarcomères et élongation des fibres (Figure 11.128) [9].
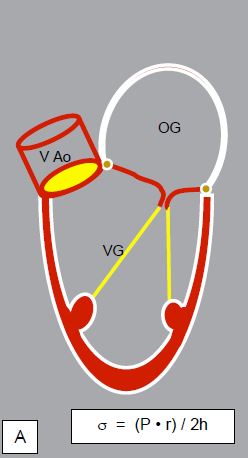

Figure 11.128 : Représentation schématique du remodelage des cavités gauches lors d'une insuffisance aortique sevère. A : cœur normal. La loi de Laplace indique que le stress de paroi (σ) est proportionnel à la pression générée (P) et au rayon de la cavité (r), et inversément proportionnel à son épaisseur (h). B : Insuffisance aortique sévère. L'oreillette gauche est dilatée, le VG subit une hypertrophie dilatative majeure, sa paroi est épaissie et sa cavité est très agrandie. L'IA chronique donne lieu aux plus importantes dilatations du VG.
Avec le temps, une fibrose myocardique s'installe progressivement; bien mise en évidence par l'IRM, elle est doublement pénalisante: le myocarde fibrosé ne participe plus à la contraction, mais il réduit la compliance diastolique. La loi de Laplace implique que, pour développer la même pression systolique, le stress de paroi est d’autant plus élevé que le ventricule est plus grand. L’IA chronique provoque le plus important agrandissement ventriculaire de toutes les cardiopathies: la masse ventriculaire peut être imposante et atteindre > 600 g (coeur bovin). Le débit de la régurgitation pouvant atteindre 5-8 L/min, le VG est contraint à un débit de 10-12 L/min pour maintenir la perfusion périphérique ! L’effort physique peut être relativement bien toléré, parce que les RAS baissent et que la tachycardie raccourcit la diastole: la fraction régurgitée diminue [7]. Les indices habituels de fonction systolique telle la fraction d’éjection sont en général dans les limites normales, mais, avec une utilisation maximale de la réserve de précharge, ils ne traduisent pas la contractilité réelle du myocarde. La dimension télésystolique du VG (diamètre > 2.5 cm/m2) est un indice plus utile pour déterminer le pronostic du patient, car elle est peu dépendante de la précharge [3]. Le rapport entre le stress de paroi et le volume en télésystole est l’élément qui prédit le mieux la récupération fonctionnelle après RVA [10].
Tant que la fonction systolique est conservée, la compliance est préservée ; le ventricule dilaté accomode de grands volumes pour des pressions de remplissage encore normales; la surcharge progressive de volume a déplacé toute la courbe de compliance vers la droite (Figure 11.129). Cependant, la pente de la relation P/V diastolique est redressée à haut volume ; dans l’insuffisance aiguë, le VG opère sur la partie ascendante de la courbe, donc à pression diastolique élevée. On voit aussi sur le diagramme pression/volume de l’IA que le triangle Emax-compliance-boucle P/V, dont la surface représente le travail interne de pression (Tpr), est de dimension variable. Dans la période de compensation, le ventricule dépense davantage d’énergie en travail externe d’éjection; ce rapport est favorable à l’efficience énergétique et à la consommation d’O2. Lorsque la dilatation s’aggrave, par contre, la tension de paroi devient excessive et la postcharge effective du VG augmente ; le travail de pression s’élève.

Figure 11.129 : Boucle pression-volume en cas d’insuffisance aortique (IA) chronique. La courbe de compliance est déplacée vers la droite à cause de l’augmentation de volume diastolique due à la régurgitation qui se fait à la pression diastolique de l’aorte, mais sa pente reste très plate car le VG est encore souple. Le volume éjecté est immense (VS) par rapport à sa valeur normale (jaune), car l’IA provoque les plus fortes dilatations ventriculaires que l’on rencontre en clinique (cœur bovin). Le travail de pression (triangle pointillé bleu clair) est augmenté à cause de la tension de paroi élevée (dilatation) en protosystole. En cas d’IA aiguë, le volume du VG est à la limite supérieure de la normale, mais n’a pas le temps de s’agrandir ; par contre, l’excès de remplissage diastolique avec une compliance normale conduit à une augmentation très importante de la pression diastolique; la boucle PV est réduite, mais surélevée.
Tant que la géométrie du VG est conservée, le remplacement de la valve défectueuse permet une bonne récupération fonctionnelle, mais lorsque le VG devient sphérique, le remodelage et les lésions fonctionnelles sont irréversibles [2]. De ce fait, la taille de VG en télésystole est le meilleur critère prédictif de la performance ventriculaire après RVA.
Avec le temps, la décompensation s’installe: la fonction systolique baisse, le VG se dilate davantage, sa tension de paroi s’élève, son éjection diminue, et la fraction régurgitée augmente. Comme la compliance diminue simultanément, les pressions diastoliques ventriculaires s’élèvent et la symptomatologie de stase veineuse pulmonaire apparaît, d’abord à l’effort puis au repos. L’ischémie est un signe tardif, qui survient sur plusieurs mécanismes [1,8].
- Augmentation de la demande en O2 à cause de la tension de paroi élevée;
- Diminution de l’apport d’O2, à cause de la pression diastolique aortique basse et de la pression intraventriculaire élevée (pression de perfusion coronarienne: PPC = PAdiast – PtdVG);
- Masse contractile disproportionnnellement augmentée par rapport au développement du réseau capillaire coronarien.
La souffrance ischémique altère encore la performance systolique et installe un cercle vicieux : ischémie → ↑ fonction systolique → ↑ IA → ↑ Vtd → ↑ tension de paroi → ↓ perfusion coronarienne → davantage d’ischémie.
Insuffisance aortique aiguë
L'IA aiguë survient essentiellement sur endocardite, dissection A ou traumatisme. Elle impose une soudaine surcharge de volume: le VG, normalement compliant, se dilate un peu, mais sans atteindre les dimensions qu’il prend dans les cas chroniques. La pression diastolique et la tension de paroi augmentent brusquement, parce que le volume télédiastolique correspond à la partie redressée de la courbe de compliance (voir Figure 11.17). Ceci est d’autant plus marqué que l’IA survient dans un cas d’HVG concentrique avec une paroi épaisse et une petite cavité comme chez un hypertendu.

Figure 11.17: La courbe de compliance normale est très plate à bas remplissage: une grande variation de volume se traduit par une très faible variation de pression. Elle se redresse lorsque le ventricule se remplit ou dans l’insuffisance diastolique. Les pressions de remplissage (PVC, PAPO) traduisent correctement la précharge en hypervolémie (partie redressée de la courbe) mais non en hypovolémie (partie plate de la courbe).
La compensation physiologique est une intense stimulation sympathique qui provoque une hypercontractilité et une tachycardie: le débit effectif est maintenu par augmentation du débit systolique total. Malheureusement, le stress sympathique induit aussi une montée des résistances systémiques, qui va accentuer la régurgitation diastolique. Lorsque la valve est quasi-détruite, les pressions diastolique aortique et télédiastolique du VG s'égalisent. L'élévation de pression par remplissage rétrograde dans le VG est si rapide, que la valve mitrale se ferme prématurément en cours de diastole [5]. Parfois, la dilatation ventriculaire empêche la mitrale de coapter normalement, et il apparaît une IM diastolique [6]. L’ischémie myocardique est fréquente à cause de l’effondrement de la pression de perfusion coronarienne (PPC = PAdiast – PtdVG), de la tension sous-endocardique et de la tachycardie.
L’IA aiguë provoque rapidement un choc cardiogène qui nécessite une prise en charge intensive avec soutien inotrope (dobutamine, milrinone-adrénaline) et vasodilatation (nitroprussiate). Les β-bloqueurs et la contre-pulsion intra-aortique sont contre-indiqués. Le RVA s’impose en urgence.
| Physiopathologie de l’insuffisance aortique |
|
L’IA augmente le Vtd du VG ; en diastole, le ventricule est rempli par la pression diastolique de l’aorte (40-80 mmHg). La tension de paroi est élevée en protosystole, ce qui constitue une augmentation de la postcharge effective. L’IA représente une surcharge de volume et une surcharge de pression. Elle induit une dilatation ventriculaire majeure.
L’IA augmente lorsque les RAS s’élèvent et diminue lorsqu’elles s’abaissent. L’éjection du VG est facilitée lorsque sa postcharge est basse parce que sa dilatation le rend très sensible au stress de paroi systolique. La baisse des RAS est donc doublement importante:
- L’IA diminue si la pression diastolique baisse
- L’éjection du VG est améliorée si la pression systolique baisse
Plus la diastole est longue, plus le volume régurgité est élevé ; la tachycardie permet de le fractionner en plus petites unités et de diminuer ainsi la fraction de régurgitation et la dilatation ventriculaire. La tachycardie est bénéfique, alors que la bradycardie est dangereuse. Fréquence optimale : 80-90 batt/min.
L’IA induit une hypertrophie excentrique. La FE ne traduit pas la fonction réelle du VG ; les dimensions télésystoliques sont une meilleur critère. La fonction est diminuée lorsque le Vts est > 2.5 cm/m2.
L’ischémie myocardique se développe tardivement sur trois phénomènes :
- ↑ mVO2 sur ↑ tension de paroi
- ↓ DO2 par ↓ PAdiast et ↑ PtdVG
- Développement capillaire insuffisant par rapport à la masse contractile
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- ARDEHALL A, SEGAL J, CHEITLIN MD. Coronary blood flow reserve in acute aortic regurgitation. J Am Coll Cardiol 1995; 25:1387-93
- BORER JS, HERROLD EM, HOCHREITER C, et al. Natural history of left ventricular performance at rest and during exercise after aortic valve replacement for aortic regurgitation. Circulation 1991; 84:III103-9
- BORROW K, GREEN LH, MANN T, et al. End-systolic volume as a predictor of postoperative left ventricular performance in volume overload from valvular regurgitation. Am J Med 1980; 68:655-60
- CARABELLO BA. Aortic regurgitation: a lesion with similarities to both aortic stenosis and mitral regurgitation. Circulation 1990: 82:1051-3
- DOWNES TR, NOMEIR AM, HACKSHAW BT, et al. Diastolic mitral regurgitation in acute but not chronic aortic regurgitation. Implications regarding the mechanism of mitral closure. Am Heart J 1989; 117:1106-12
- EUSEBIO J, LOUIE EK, EDWARDS DC, et al. Alterations in transmitral flow dynamics in patients with early mitral valve closure and aortic regurgitation. Am Heart J 1994; 128:941-8
- KAWANISHI DT, McKAY CT, CHANDRARATNA AN, et al. Cardiovascular response to dynamic exercise in patients with chronic symptomatic mild-to-moderate and severe aortic regurgitation. Circulation 1986; 73:62-9
- NITENBERG A, FOULT JM, ANTONY I, et al. Coronary flow and resistance reserve in patients with chronic aortic regurgitation, angina pectoris and normal coronary arteries. J Am Coll Cardiol 1988; 11:478
- OPIE LH. Heart Physiology. From cell to circulation. 4th edition. Philadelphia: Lippincott Williams & Wilkins 2004, 402-430
- TANIGUSHI K, NAKANO S, MATSUDA H, et al. Timing of operation for aortic regurgitation: Relation to postoperative contractile state. Ann Thorac Surg 1990; 50:779-85
