L’insuffisance aortique (IA) est une pathologie fréquence lorsqu’elle est mineure ; son incidence est de 5-10% dans la population générale [7]. L’IA modérée-à-sévère, plus rare (prévalence 0.5%), relève anatomiquement de deux structures et de deux mécanismes différents (Figure 11.126).
- Dilatation de l’anneau et de la racine aortique; les cuspides sont normales;
- Lésions de la valve proprement dite; la pathologie est située au niveau des cuspides.


Figure 11.126 : Les différents types anatomo-pathologiques d’insuffisance aortique. A : maladie annulo-ectasiante ; la racine de l’aorte ascendante et l’anneau valvulaire sont dilatés mais les cuspides sont normales (IA type I) ; le jet de l’IA est central. B : la racine de l’aorte est normale mais les cuspides sont lésées ; elles peuvent être prolabantes (IA type II) ou rétractées (IA type III). Le jet de l’IA est en général excentrique ; il est dirigé à l’opposé de la cuspide prolabante ou du côté de la cuspide rétractée.
Dans le premier cas, il s’agit de la maladie annulo-ectasiante de l’aorte ascendante, qui devient de plus en plus fréquente en Occident et représente actuellement la moitié des cas d’insuffisance aortique [3]: la dilatation de l’anneau et de la jonction sino-tubulaire tend les bords libres des cuspides, qui sont normales, et les empèche de coapter proprement (Vidéo). Cette affection relève de la médianécrose cystique de l’aorte, isolée ou associée au syndrome de Marfan, de la dégénérescence dilatative de l’aorte liée à l’âge (anévrysme), ou de syndromes inflammatoires systémiques (spondylite ankylosante, syndrome de Reiter ou de Behçet, aortite syphilitique, etc). Enfin, le "flap" intimal d’une dissection aortique de type A peut déstabiliser l’appareil valvulaire ou prolaber à travers la valve en diastole (Vidéo).
Vidéo: dilatation de la racine aortique entraînant une non-coaptation diastolique des cuspides dans un syndrome de Marfan (vues simultanées en court-axe et en long-axe).
Vidéo: Vue long-axe de la racine aortique dans une dissection A; la membrane ("flap") protrude à travers la valve aortique en diastole, occasionnant une insuffisance majeure.
Vidéo: dilatation de la racine aortique entraînant une non-coaptation diastolique des cuspides dans un syndrome de Marfan (vues simultanées en court-axe et en long-axe).
Vidéo: Vue long-axe de la racine aortique dans une dissection A; la membrane ("flap") protrude à travers la valve aortique en diastole, occasionnant une insuffisance majeure.
Dans le deuxième cas, l’insuffisance est due à des lésions des cuspides, qui relèvent de plusieurs étiologies différente
- Lésion dégénérative : dégénérescence myxoïde ou fibro-élastique (prolapsus), calcifications (les blocs calciques rigides dont les valvules sont infiltrées ne permettent plus l’étanchéité en diastole) (Vidéos).
Vidéo: vue long-axe d'une insuffisance aortique modérée au flux Doppler couleur.
Vidéo: Prolapsus de la cuspide coronarienne droite occasionnant une insuffisance aortique excentrique majeure.
Vidéo: image long-axe 130° du Doppler couleur dans un cas de maladie aortique avec une insuffisance mineure et une sténose serrée; dans l'aorte ascendante, le flux est étroit et tourbillonnaire.
- Bicuspidie: bien que cette malformation conduise le plus souvent à une sténose, il arrive qu’elle se manifeste par une insuffisance isolée ou prédominante ; sa prévalence est de 1-2% dans la population générale (Vidéos).
Vidéo: vue court-axe d'une bicuspidie aortique; les cuspides coronaires gauche et droite sont fusionnées, mais il existe 3 commissures visibles à leurs positions anatomiques normales.
Vidéo: Vue tridimensionnelle court-axe d'une bicuspidie aortique.
- RAA: la fusion commissurale et la rétraction cicatricielle des cuspides infiltrées de tissu fibreux les empèche de coapter en diastole.
- Endocardite: la destruction des feuillets, leur perforation, ou le prolapsus de végétations à travers la valve, causent une fuite transvalvulaire (Vidéos); dans le pannus infectieux qui ceint la racine des cuspides peut se former un abcès, le plus fréquemment à l’angle mitro-aortique.
Vidéo: Végétation pendulaire sur la cuspide non-coronaire dans une endocardite aortique (vue long-axe)
Vidéo: Végétations sessiles dans une endocardite aortique; les végétations apparaissent comme un tissu mou, moins échogène que les structures anatomiques.
- Perte du support commissural : traumatisme, dissection A, CIV supracristale.
- Maladie systémique: Marfan, syphilis, Ehlers-Danlos, arthrite rhumatoïde.
- Toxicité médicamenteuse : méthysergide, ergotamine, pergolide, fenfluramine, phentermine, aminorex, benfluorex (Mediator®) ; la toxicité des anorexiants est connue depuis le début des années ‘90.
L’insuffisance aortique peut évoluer lentement et rester longtemps asymptomatique; mais elle peut également se présenter de manière foudroyante (IA aiguë), le plus souvent suite à une dissection, une endocardite ou un traumatisme.
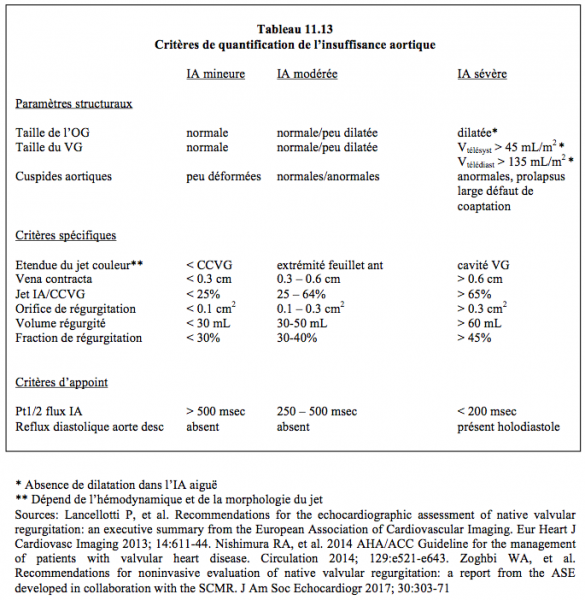
Les critères définissant l’IA sévère sont (voir Tableau 11.13) [1,5,6,9,10]:
- Volume régurgité ≥ 60 ml (fraction de régurgitation ≥ 45%);
- PA diastolique < 50 mmHg, PA différentielle très large (> 80 mmHg);
- Hypertrophie dilatative du VG;
- Cavité du VG de grande taille (diamètre télédiastolique > 4 cm/m2, volume télésystolique > 45 mL/m2, volume télédiastolique > 135 mL/m2); ce critère est absent en cas d’IA aiguë;
- Jet de régurgitation s’étendant jusqu’à mi-ventricule (dépend de l'hémodynamique);
- Rapport diamètre jet de l’IA/diamètre CCVG > 0.6;
- Surface de l’orifice de régurgitation > 0.3 cm2.
Par analogie à la classification de Carpentier pour l'IM, on décrit actuellement 3 types d’IA en fonction de la mobilité des cuspides aortiques (classification d'El Khoury) (Figure 11.127) [2,4].
- Type I : cuspides normales, dilatation de la racine aortique ; jet d'IA central.
- Type II : excès de tissu et de mouvement d’une ou des cuspides, prolapsus ; jet excentrique.
- Type III : mouvement restrictif des cuspides, calcifications ; jet variable.
Le type I est à son tour divisé en 4 catégories selon le niveau de la dilatation aortique et le mécanisme de la fuite [2,4,8].
- Type Ia: dilatation de l'aorte supra-coronaire (jonction sino-tubulaire et aorte ascendante).
- Type Ib: dilatation de la racine aortique (sinus de Valsalva).
- Type Ic: dilatation de l'anneau aortique.
- Type Id: perforation d'un feuillet.

Figure 11.127 : Les différents types anatomo-pathologiques d’insuffisance aortique selon El Khoury [2,4,8].
| Insuffisance aortique |
|
L’insuffisance aortique (IA) relève de deux mécanismes différents :
- Dilatation de l’anneau et de la racine aortique, cuspides normales, jet central
- Lésions des cuspides, jet excentrique
Etiologies :
- Maladie annulo-ectasiante, anévrysme, Marfan, flap d’une dissection
- Bicuspidie, dégénérescence, RAA, endocardite, traumatisme, toxicité médicamenteuse
Critères de définition de l’IA sévère :
- Volume régurgité ≥ 60 mL, fraction de régurgitation > 45%
- Surface de l’orifice de régurgitation > 0.3 cm2
- HVG dilatative (Dtd VG > 4 cm/m2) ; taille du VG normale en cas d’IA aiguë
- PA diast < 50 mmHg, PAdiff > 80 mmHg
Classification des IA:
- Type I: cuspides normales, dilatation de la racine aortique
- Type II: excès de tissu et de mouvement d’une ou des cuspides, prolapsus
- Type III: mouvement restrictif des cuspides, calcifications
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BOODHWANI MJ, DE KERCHOVE L, GLINEUR D, et al. Repair-oriented classification of aortic insufficiency: impact on surgical techniques and clinical outcomes. J Thorac Cardiovasc Surg 2009; 137:286-94
- DARE AJ, VEINOT JP, EDWARDS WD, et al. New observations on the etiology of aortic valve disease. Hum Pathol 1993; 24:1330
- EL KHOURY G, GLINEUR D, RUBAY J, et al. Functional classification of aortic root/valve abnormalities and their correlation with etiologies and surgical procedures. Cur Opin Cardiol 2005; 20:115-21
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NKOMO VT, GARDIN JM, SKELTON TN, et al. Burden of valvular heart diseases: a population-based study. Lancet 2006; 368:1005-11
- PRODROMO J, D'ANCONNA G, AMADUCCI A, et al. Aortic valve repair fort aortic insufficiency: a review. J Cardiothorac Vasc Anesth 2012; 26:923-32
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developed in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71